题目内容
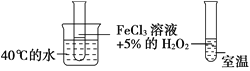
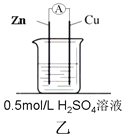
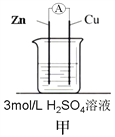
【题目】为了探究影响化学反应速率的因素,现设计如图所示两组对比试验
第1组 | 第2组 |
|
|
(1)第1组:实验目的是探究________对化学反应速率的影响。
(2)第2组:甲中电流表指针偏转程度更大,说明反应物浓度越大,化学反应速率_____。
(3)第2组甲中能量转化的形式是______________(填“电能转化为化学能”或“化学能转化为电能”),锌片________(填“失去”或“得到”)电子,当放出3.36L(标准状况)气体时,理论上消耗的锌的质量是________g,通过导线的电子有___________mol 。
【答案】 温度 越快 化学能转化为电能 失去 9.75 0.3
【解析】(1)第1组实验中只有温度不同,探究的是温度对化学反应速率的影响,故答案为:温度;
(2)第2组实验中甲中电流表指针偏转程度更大,是因为溶液中氢离子的浓度大于乙中氢离子的浓度,说明反应物浓度越大,化学反应速率越快,故答案为:越快;
(3)第2组甲中含有2个电极、电解质溶液,形成了闭合电路,构成原电池,将化学能转化为电能,其中活泼的锌片失去电子,是负极,标准状况下3.36L氢气的物质的量为![]() =0.15mol,转移电子0.15mol×2=0.3mol,根据得失电子守恒,消耗的锌的质量为
=0.15mol,转移电子0.15mol×2=0.3mol,根据得失电子守恒,消耗的锌的质量为![]() ×65g/mol=9.75g,故答案为:化学能转化为电能 ;失去;9.75;0.3。
×65g/mol=9.75g,故答案为:化学能转化为电能 ;失去;9.75;0.3。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目