题目内容
【题目】按要求回答有关问题:
(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
(2)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_________________ mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
【答案】 2.5 2.8×10-3 6×10-3 0.62 2.0×10-5 5×10-3
【解析】(1)在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应达到平衡后H2O的物质的量分数为0.02,设转化得到COS为x,则
H2S(g)+CO2(g)![]() COS(g) +H2O(g)
COS(g) +H2O(g)
开始(mol) 0.4 0.1 0 0
转化(mol) x x x x
平衡(mol) 0.4-x 0.1-x x x
![]() =2%,解得x=0.01mol,H2S的平衡转化率=
=2%,解得x=0.01mol,H2S的平衡转化率=![]() ×100%=2.5%,反应平衡常数K=
×100%=2.5%,反应平衡常数K=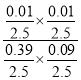 =2.8×10-3,故答案为:2.5;2.8×10-3;
=2.8×10-3,故答案为:2.5;2.8×10-3;
(2)NH3H2O的Kb=1.8×10-5,若氨水的浓度为2.0molL-1,由Kb=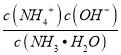 可知c(OH-)=
可知c(OH-)=![]() mol/L=6.0×10-3mol/L,当c(OH-)降至1.0×10-7 molL-1时,c(H+)=1.0×10-7 molL-1,H2SO3的Ka2=6.2×10-8,由Ka2=
mol/L=6.0×10-3mol/L,当c(OH-)降至1.0×10-7 molL-1时,c(H+)=1.0×10-7 molL-1,H2SO3的Ka2=6.2×10-8,由Ka2=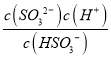 可知c(SO32-)/c(HSO3-)=
可知c(SO32-)/c(HSO3-)=![]() =0.62,故答案为:6.0×10-3;0.62;
=0.62,故答案为:6.0×10-3;0.62;
(3)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=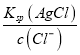 =
=![]() =2.0×10-5mol/L,此时溶液中c(CrO42-)=
=2.0×10-5mol/L,此时溶液中c(CrO42-)=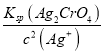 =
= =5.0×10-3mol/L,故答案为:2.0×10-5 ;5.0×10-3。
=5.0×10-3mol/L,故答案为:2.0×10-5 ;5.0×10-3。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】下列有关实验操作、实验现象和所得结论均正确的是
实验操作 | 实验现象 | 结论 | |
A | 在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液 | 产生大量气泡 | Fe3+能催化H2O2的分解 |
B | 用0.100molL-1盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) | 溶液由橙色变红色,且在半分钟内不恢复 | 滴定到达终点 |
C | 向浓度均为0.1 mol·L-1NaCl 和NaI 混合溶液中滴加少量AgNO3溶液 | 产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
D | 往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液 | 产生白色沉淀,红色褪去 | 证明CO32-水解呈碱性 |
A. A B. B C. C D. D








