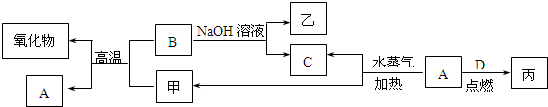
题目内容
在标准状况下将c mol Cl2通入含a mol FeBr2和b mol FeI2的溶液中,当c取不同值时,反应后所得溶液中有不同溶质(不考虑生成物与水反应)。(1)将下表中空格填满。
c的取值(用含a、b的代数式表示) | 反应后溶液中溶质的化学式(只要求写出盐类化合物) |
| FeBr2、FeI2、FeCl2 |
b=c |
|
b<c< |
|
| FeBr3、FeCl3 |
| FeCl3 |
(2)若a=b=1,c=2时,反应后溶液中属于盐类的溶质是________________________(写化学式),这些溶质的物质的量之比是__________。
(3)若a=b=1,c=2.5时,写出Cl2通入溶液中总的离子方程式(限写一个,但需包括所有的离子反应):__________________________________________________。
(1)见下表
c的取值(用含a、b的代数式表示) | 反应后溶液中溶质的化学式(只要求写出盐类化合物) |
0<c<b |
|
| FeBr2、FeCl2 |
| FeBr2、FeBr3、FeCl2、FeCl3 |
|
|
c≥ |
|
(2)FeBr3、FeCl3 1∶2
(3)2Fe2++2I-+Br-+5/2Cl2====2Fe3++I2+1/2Br2+5Cl-
即:4Fe2++4I-+2Br-+5Cl2====4Fe3++2I2+Br2+10Cl-
解析:还原性强弱:I->Fe2+>Br-,所以Cl2依次将这些离子氧化,原溶液n(Fe2+)=(a+b)mol,n(I-)=2b mol,n(Br-)=2a mol,由
Cl2+2I-====I2+2Cl-,
Cl2+2Fe2+====2Fe3++2Cl-,
Cl2+2Br-====Br2+2Cl-,依次计算。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
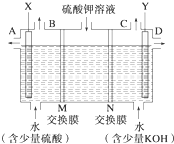 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.