题目内容
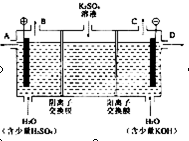
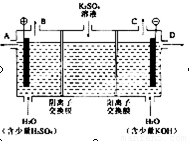
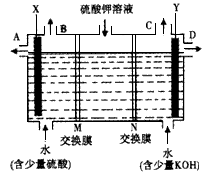
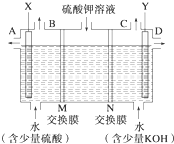 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.(1)X极与电源的
正
正
(填“正”或“负”)极相连,氢气从C
C
(填“A”、“B”、“C”或“D”)口导出.(2)离子交换膜只允许一类离子通过,则M为
阴离子
阴离子
(填“阴离子”或“阳离子”,下同)交换膜,N为阳离子
阳离子
交换膜.(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的反应式为
H2-2e-+2OH-═2H2O
H2-2e-+2OH-═2H2O
.(4)若在标准状况下,制得11.2L氢气,则生成硫酸的质量是
49g
49g
,转移的电子数为6.02×1023
6.02×1023
.分析:(1)根据加入的物质知,X电极附近生成硫酸,Y电极附近生成氢氧化钾,则X电极上氢氧根离子放电,Y电极上氢离子放电,所以X是阳极,Y是阴极,阳极与电源正极相连;阳极上生成氧气,阴极上生成氢气;
(2)电解过程中,电解质溶液中阳离子向阴极移动,阴离子向阳极移动;
(3)原电池中负极上失电子发生氧化反应;
(4)根据转移电子守恒计算生成硫酸的质量.
(2)电解过程中,电解质溶液中阳离子向阴极移动,阴离子向阳极移动;
(3)原电池中负极上失电子发生氧化反应;
(4)根据转移电子守恒计算生成硫酸的质量.
解答:解:(1)题图中左边加入含硫酸的水,右侧加入含KOH的水,说明左边制硫酸,右边制备KOH溶液,氢氧根离子在阳极放电,同时电解后溶液呈酸性,氢离子在阴极放电,同时电解后溶液呈碱性,则X为阳极,Y为阴极,所以X连接电源正极;
Y电极上氢离子放电生成氢气,所以氢气从C口导出,
故答案为:正;C;
(2)OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO42-通过M交换膜向左边迁移,即M为阴离子交换膜;
H+在Y极发生还原反应,使右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜,
故答案为:阴离子;阳离子;
(3)氢氧燃料碱性电池中,通入氢气的电极是负极,负极上氢气失电子发生氧化反应,电极反应式为
H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O;
(4)n(H2)=
=0.5mol,根据2H++2e-═H2↑知,得电子的物质的量为1mol,得电子数为6.02×1023,X极的反应式为4OH--4e-═2H2O+O2↑,根据得失电子守恒知,生成H+的物质的量为1mol,根据氢原子守恒得生成0.5mol H2SO4,m(H2SO4)=nM=0.5mol×98g/mol=49g,
故答案为:49g;6.02×1023.
Y电极上氢离子放电生成氢气,所以氢气从C口导出,
故答案为:正;C;
(2)OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO42-通过M交换膜向左边迁移,即M为阴离子交换膜;
H+在Y极发生还原反应,使右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜,
故答案为:阴离子;阳离子;
(3)氢氧燃料碱性电池中,通入氢气的电极是负极,负极上氢气失电子发生氧化反应,电极反应式为
H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O;
(4)n(H2)=
| 11.2L |
| 22.4L/mol |
故答案为:49g;6.02×1023.
点评:本题考查了原电池和电解池原理,正确推断电解池阴阳极是解本题关键,根据加入水溶液的溶质确定电极产物,结合电极产物确定阴阳极,再结合转移电子守恒进行有关计算,难度中等.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题: