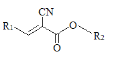
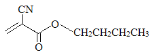题目内容
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示。
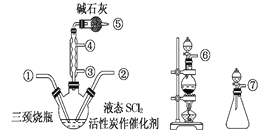
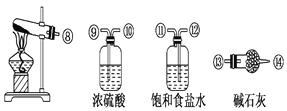
(1)实验室制取SOCl2在三颈烧瓶中进行,整个装置所选仪器的连接顺序是⑥→___→①;___→②(已知①处通入Cl2、除杂装置可以重复使用)。
(2)冷凝管上连接的干燥管的作用是:①尾气处理;②___。
(3)实验室制Cl2的离子方程式为___。
(4)该实验中制取SO2,下列最适宜的试剂是___(填下列字母编号)。
A.Cu固体与18.4molL-1硫酸
B.Na2SO3固体与20%硫酸
C.Na2SO3固体与70%硫酸
D.Na2SO3固体与18.4molL-1硫酸
(5)预测SOCl2遇水反应的化学方程式为___。
(6)取少量的SOCl2加入足量NaOH溶液,振荡、静置得到无色溶液,检验溶液中存在Cl-的试剂有____。
【答案】→→⑨→⑩ ⑦→⑨→⑩ 防止空气中的水蒸气进入反应装置而使SOCl2水解 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O C SOCl2+H2O=SO2↑+2HCl Ba(NO3)2、稀HNO3、AgNO3
Mn2++Cl2↑+2H2O C SOCl2+H2O=SO2↑+2HCl Ba(NO3)2、稀HNO3、AgNO3
【解析】
(1)根据方程式SO2+Cl2+SCl2=2SOCl2可知,SO2、Cl2、SCl2反应生成SOCl2,实验室用二氧化锰、浓盐酸制取氯气,用饱和食盐水除去氯化氢、用浓硫酸干燥后通入三口烧瓶;亚硫酸钠固体和浓硫酸反应制取二氧化硫,用浓硫酸干燥后通入三口烧瓶,注意洗气瓶长进短出;
(2)根据SOCl2遇水剧烈反应分析;
(3)二氧化锰、浓盐酸加热生成氯化锰、氯气、水;
(4)根据强酸制弱酸分析;
(5)SOCl2遇水反应,产生白雾说明生成了氯化氢,有刺激性气味的气体产生说明生成二氧化硫气体;
(6)取少量的SOCl2加入足量NaOH溶液,振荡、静止得到无色溶液,溶液中含亚硫酸根离子和氯离子,检验氯离子可用硝酸和硝酸银溶液。
(1)根据方程式SO2+Cl2+SCl2=2SOCl2可知,SO2、Cl2、SCl2反应生成SOCl2,实验室用二氧化锰、浓盐酸制取氯气,用饱和食盐水除去氯化氢、用浓硫酸干燥后通入三口烧瓶;亚硫酸钠固体和浓硫酸反应制取二氧化硫,用浓硫酸干燥后通入三口烧瓶,洗气瓶长进短出,所以整个装置所选仪器的连接顺序是⑥→→→⑨→⑩→①;⑦→⑨→⑩→②;
(2)SOCl2遇水剧烈水解,冷凝管上连接的干燥管,可以防止空气中的水蒸气进入反应装置使SOCl2遇水水解;
(3)二氧化锰、浓盐酸加热生成氯化锰、氯气、水,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)A.Cu固体与18.4molL-1硫酸,能放出二氧化硫,消耗的硫酸多,故不选A;
B.Na2SO3固体与20%硫酸,硫酸浓度太小,因SO2的溶解度较大,放出二氧化硫的量少,故不选B;
C.Na2SO3固体与70%硫酸,硫酸浓度适合,反应生成二氧化硫气体,故选C;
D. 18.4molL-1硫酸中氢离子浓度很小,Na2SO3固体与18.4molL-1硫酸不能制备二氧化硫气体,故不选D;
(5)SOCl2遇水反应,成了氯化氢和二氧化硫,反应的化学方程式是SOCl2+H2O=SO2↑+2HCl;
(6)取少量的SOCl2加入足量NaOH溶液,振荡、静止得到无色溶液,含亚硫酸根离子和氯离子,检验溶液存在的Cl-的方法是取少量溶液于试管中,加入过量Ba(NO3)2溶液,静置,取上层清液,滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-。

【题目】实验小组探究甲烷与氯气的取代反应,装置、现象如下:
现象 |
ⅰ.光照后,产生白雾,混合气体颜色变浅 ⅱ.试管内液面上升至试管的2/3;试管壁和液面上出现少量油状液滴 |
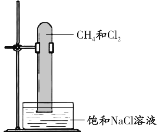
下列说法不正确的是
A. 饱和食盐水可以减少氯气的溶解
B. 油状液滴的主要成分是一氯甲烷
C. 产生白雾以及试管内液面上升证明有氯化氢生成
D. 为了探究反应条件,可用黑色纸套套住装满甲烷和氯气的试管,一段时间后进行观察