题目内容
(12分)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于____________晶体;基态Ni原子的电子排布式为_______________;
写出两种与配体CO互为等电子体微粒的化学式_____________、________________ 。
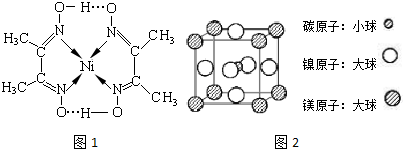
(2)某镍配合 物结构如图所示,分子内含有的作用力有____________(填序号)。
物结构如图所示,分子内含有的作用力有____________(填序号)。
| A.氢键 | B.离子键 | C.共价键 | D.金属键 E.配位键 |
如①CH2=CH2、②HC ≡ CH、③
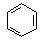 ④HCHO等,其中碳原子采取sp2杂化的分子有_________(填序号);HCHO分子的空间构型为:__________。
④HCHO等,其中碳原子采取sp2杂化的分子有_________(填序号);HCHO分子的空间构型为:__________。(4)据报道,某种含有镁、镍和碳三种元素的晶体具有超导性,其结构如图所示。则该晶体的化学式为__________ 。晶体中每个镁原子周围距离最近的镍原子有_________个。

(12分)
(1)分子(1分)
1s22s22p63s23p63d84s2或[Ar] 3d84s2 (1分)
N2、CN—(2分,各1分)
(2)A、C、E(2分,选对1个不给分,选对2个给1分,选错不给分)
(3)①③④(2分,选对1个不给分,选对2个给1分,选错不给分)
平面三角(1分)
(4)MgCNi3(1分) 12(2分)
解析

近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
根据上表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。 某镍配合物结构如图所示,分子内含有的作用力有 (填序号)。

A氢键;B离子键;C共价键;D金属键;E配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
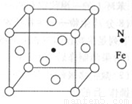
(6)铁能与氮形成一种磁性材料,其晶胞结构如图所示,则该磁性材料的化学式为 。
 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有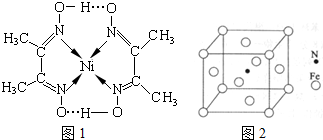 近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致.钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致.钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3