题目内容
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
根据上表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
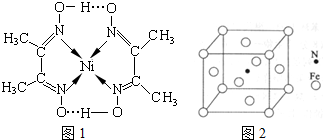
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。 某镍配合物结构如图所示,分子内含有的作用力有 (填序号)。
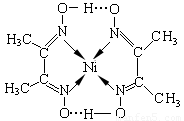
A氢键;B离子键;C共价键;D金属键;E配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
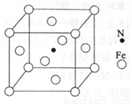
(6)铁能与氮形成一种磁性材料,其晶胞结构如图所示,则该磁性材料的化学式为 。
(1)3d54s1 (2分)
(2) sp3 (2分)
(3)Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态。)(2分)
(4)ACE(2分) O>N>C(2分)
(5)分子晶体(1分)
(6)Fe4N (2分)
【解析】
试题分析:(1)由核外电子排布规律可知,基态铬原子的价电子排布式为3d54s1;(2)碳与硅形成的碳化硅晶体结构与金刚石、晶体硅相似,则碳原子采取sp3杂化;(3)对比二者的价电子排布式可知,Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态),故气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难;(4)读图可知,该配合物中含有氢键、共价键、配位键,不含金属键、离子键,故ACE正确;该配合物含有C、N、O三种第二周期的非金属,电负性:C<N<O;(5)由挥发性及性质推断,四羰基镍属于分子晶体;(6)由均摊法可知,1个晶胞或晶体所含Fe原子数为8×1/8+6×1/2=4,所含N原子数为1×100%=1,则该材料或晶胞的化学式为Fe4N。
考点:考查电子排布式及应用、杂化轨道、化学键、电负性、晶体类型、晶体结构和组成计算等相关知识。

| A、光导纤维具有很强的导电能力,所以大量用于制造通信光缆 | B、明矾常用作净水剂,是因为它具有消毒杀菌的作用 | C、氨常用作制冷剂,是因为其沸点极低,很容易液化 | D、SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾 |
| A、氯气化学性质很活泼,但是干燥的液氯能用钢瓶贮存 | B、氯气和液氯是两种不同物质 | C、可以用浓硫酸除去氯气中的水蒸气 | D、氯气有毒,它曾在战争中被用于制造毒气弹 |
 近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致.钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致.钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3