题目内容
氯气是一种重要的化工原料,某课外学习小组设计了如下装置制取氯气并验证氯气的某些性质.

请回答:
(1)用双线桥法表示实验室制备氯气的化学方程式 ,仪器甲的名称为 .
(2)装置B中浓硫酸的作用是 .
(3)装置C中的现象 .
(4)装置D为氯气的收集装置,a处应连接 (b或c).
(5)装置E的作用是 ,NaOH溶液中发生的化学反应方程式为 .

请回答:
(1)用双线桥法表示实验室制备氯气的化学方程式
(2)装置B中浓硫酸的作用是
(3)装置C中的现象
(4)装置D为氯气的收集装置,a处应连接
(5)装置E的作用是
考点:实验装置综合,氯气的实验室制法
专题:实验设计题
分析:(1)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物;甲是分液漏斗;
(2)浓硫酸具有吸水性,能作干燥剂;
(3)氯气能使湿润的有色布条褪色,不能使干燥的有色布条褪色;
(4)氯气的密度大于空气且常温下和空气不反应,可以采用向上排空气法收集;
(5)氯气有毒,不能直接排空,应该用碱性物质吸收氯气.
(2)浓硫酸具有吸水性,能作干燥剂;
(3)氯气能使湿润的有色布条褪色,不能使干燥的有色布条褪色;
(4)氯气的密度大于空气且常温下和空气不反应,可以采用向上排空气法收集;
(5)氯气有毒,不能直接排空,应该用碱性物质吸收氯气.
解答:
解:(1)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: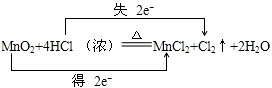 ,
,
故答案为: ;
;
(2)浓硫酸具有吸水性,能作干燥剂,从B装置出来的氯气中含有水分,对实验造成干扰,所以装置B中浓硫酸的作用是干燥氯气,故答案为:干燥氯气;
(3)氯气和干燥的有色布条不反应,氯气和水反应生成次氯酸,次氯酸有漂白性,所以能使湿润的有色布条褪色,则看到的现象是:湿润的有色布条褪色,干燥的有色布条不褪色,故答案为:湿润的有色布条褪色,干燥的有色布条不褪色;
(4)氯气的密度大于空气且常温下和空气不反应,可以采用向上排空气法收集,故选c;
(5)氯气有毒,不能直接排空,应该用碱性物质吸收氯气,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:尾气处理;Cl2+2NaOH=NaCl+NaClO+H2O.
 ,
,故答案为:
 ;
;(2)浓硫酸具有吸水性,能作干燥剂,从B装置出来的氯气中含有水分,对实验造成干扰,所以装置B中浓硫酸的作用是干燥氯气,故答案为:干燥氯气;
(3)氯气和干燥的有色布条不反应,氯气和水反应生成次氯酸,次氯酸有漂白性,所以能使湿润的有色布条褪色,则看到的现象是:湿润的有色布条褪色,干燥的有色布条不褪色,故答案为:湿润的有色布条褪色,干燥的有色布条不褪色;
(4)氯气的密度大于空气且常温下和空气不反应,可以采用向上排空气法收集,故选c;
(5)氯气有毒,不能直接排空,应该用碱性物质吸收氯气,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:尾气处理;Cl2+2NaOH=NaCl+NaClO+H2O.
点评:本题考查了氯气的实验室制法,明确实验原理是解本题关键,根据物质的性质选取合适的洗气装置、收集装置、尾气处理装置,知道仪器连接顺序,题目难度不大.

练习册系列答案
相关题目
由长周期元素和短周期元素共同构成的族是( )
①0族 ②主族 ③副族 ④第Ⅷ族.
①0族 ②主族 ③副族 ④第Ⅷ族.
| A、①② | B、①③ | C、②③ | D、③④ |
在实验室中制取纯净、干燥的氯气时,可使气体依次通过( )
| A、饱和食盐水、浓硫酸 |
| B、NaOH溶液、浓硫酸 |
| C、NaHCO3溶液、碱石灰 |
| D、浓硫酸、饱和食盐水 |
罗马大学Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构与白磷P4相似.已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.由此判断下列说法正确的是( )
| A、N4属于一种新型的化合物,分子内存在非极性键 |
| B、N4与N2互为同位素,化学性质相似,物理性质不同 |
| C、N4沸点比P4(白磷)高 |
| D、1mol N4气体转变为N2将放出882kJ热量 |
 如图为实验室制取氨的实验装置.
如图为实验室制取氨的实验装置. 某化学兴趣小组的同学用如图所示装置研究电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.试回答下列问题:
某化学兴趣小组的同学用如图所示装置研究电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.试回答下列问题:
 根据如图所示的装置,回答下列问题:
根据如图所示的装置,回答下列问题: