题目内容
在标准状况下,某烃的密度是1.25g?L-1,一定体积的该烃完全燃烧生成4.48L CO2和3.6g水,求该烃的分子式.
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:根据M=ρVm确定该烃摩尔质量,计算二氧化碳、水的物质的量,根据原子守恒确定烃的最简式,进而确定分子式.
解答:
解:标准状况下,某烃的密度是1.25g?L-1,则该烃的摩尔质量=1.25g/L×22.4L/mol=28g/mol,
一定体积的该烃完全燃烧生成4.48L CO2和3.6g水,n(CO2)=
=0.2mol,n(H2O)=
=0.2mol,故烃中N(C):N(H)=0.2mol:0.2mol×2=1:2,即最简式为CH2,
令该烃的分子式为(CH2)n,则14n=28,故n=2,故该烃分子式为C2H4,
答:该烃分子式为C2H4.
一定体积的该烃完全燃烧生成4.48L CO2和3.6g水,n(CO2)=
| 4.48L |
| 22.4L/mol |
| 3.6g |
| 18g/mol |
令该烃的分子式为(CH2)n,则14n=28,故n=2,故该烃分子式为C2H4,
答:该烃分子式为C2H4.
点评:本题考查有机物分子式的确定,难度不大,注意掌握燃烧法结合原子守恒确定有机物分子式.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
能充分说明在恒温恒容下的密闭容器中,N2(g)+O2(g)?2NO(g)已达到化学平衡状态的是( )
| A、N2、O2和NO的物质的量浓度相等 |
| B、反应体系中的压强不随时间变化 |
| C、N2、O2、NO三种物质同时存在 |
| D、单位时间内生成1mol N2 同时消耗1mol O2 |
“类推”是一种重要的学习方法,但有时会产生错误,下列类推结论正确的是( )
| A、第2周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 |
| B、ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
| C、晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 |
| D、干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
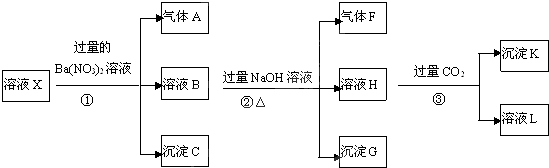
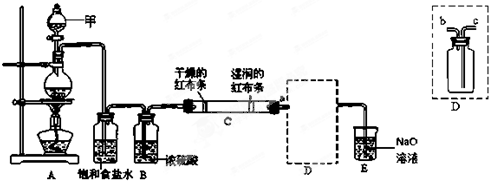
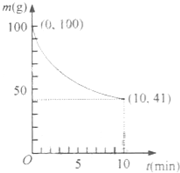 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为: