题目内容
【题目】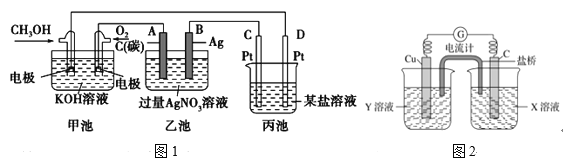
(1)如图1是一个化学过程的示意图。
①甲池中OH-移向______极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式_________。
③乙池中总反应的离子方程式____________。
④当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图2所示原电池,回答下列问题:
①写出电极反应式:正极________;负极___________。
②图中X溶液是________,Y溶液是_________。
③原电池工作时,盐桥中的______(填“阳”或“阴”)离子向X溶液方向移动。
【答案】阳 CH3OH CH3OH-6e-+8OH-=CO32-+6H2O 4Ag++2H2O![]() 4Ag+O2↑+4H+ BD 2Fe3++2e-=2Fe2+ Cu-2e-=Cu2+ FeCl3 CuCl2
4Ag+O2↑+4H+ BD 2Fe3++2e-=2Fe2+ Cu-2e-=Cu2+ FeCl3 CuCl2
【解析】
(1)根据图像可知,图1甲池为原电池,且通入甲醇的一极为负极,与负极相连的乙池、丙池中的D、B为阴极;通入氧气的一极为正极,与正极相连的A、C为阳极;
(2)图2为原电池,Cu失电子生成铜离子,作负极;C电极上铁离子得电子作正极;
(1)①分析可知,甲池为原电池,电池内部,阴离子向负极移动,则OH-移向CH3OH电极移动;
②甲醇失电子与氢氧根离子反应生碳酸根离子,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
③乙池为电解池,阳极上水失电子生成氧气和氢离子,阴极银离子得电子生成银,总电极方程式4Ag++2H2O![]() 4Ag+O2↑+4H+;
4Ag+O2↑+4H+;
④当乙池中B(Ag)极的质量增加5.40g,转移电子0.05mol,
A.电解MgSO4溶液时,无金属生成,与题意不符,A错误;
B.电解CuSO4溶液时,若全部为Cu生成1.6g金属,符合题意,B正确;
C.电解NaCl溶液时,无金属生成,与题意不符,C错误;
D.电解AgNO3溶液时,若全部为Ag,生成5.4g金属,只生成1.6g时,说明硝酸银溶液不足,银离子反应完毕生成1.6g银,还有氢气生成,符合题意,D正确;
答案为BD;
(2)①反应Cu+2FeCl3=CuCl2+2FeCl2中,Cu失电子作负极,电极反应式为Cu-2e-=Cu2+;铁离子得电子做正极,电极反应式为2Fe3++2e-=2Fe2+;
②为了使电池减少损耗,使用持久,则Cu电极电解液为硫酸铜;X池电解液为氯化铁;
③原电池工作时,电池内部阳离子向正极移动,阴离子向负极移动;