题目内容
【题目】苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氧法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
![]()
(1)若升高温度,该反应的平衡常数变大,则ΔH____________(填“大于0”或“小于0”)。该反应在_______________条件下能自发进行(填“较高温度”、“较低温度”或“任何温度”)。
(2)维持体系总压强ρ恒定,在温度T时,物质的量为2mol、体积为1L的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为80%,则在该温度下反应的平衡常数K=_____。
(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)
(4)工业上,通常在乙苯蒸汽中掺混水蒸气(原料中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
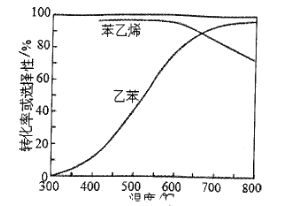
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实_________________________。
②控制反应温度为600℃的理由是_____________________。
(5)某燃料电池以乙苯为燃料,Li2CO3与K2CO3混合的碳酸盐为电解质的高温型燃料电池,其负极的电极反应式为_____________________,正极上通入的气体为______________。
【答案】 △H大于0 较高温度 32/9 mol/L 0.25mol·L-1·min-1 等于 正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果 600℃时,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,选择性下降。高温还可能使催化剂失活,且能耗大 ![]() -42e-+21CO32--→5H2O+29CO2 O2(或空气)、CO2
-42e-+21CO32--→5H2O+29CO2 O2(或空气)、CO2
【解析】(1)若升高温度,该反应的平衡常数变大,说明平衡正向移动,表明正反应为吸热反应,则ΔH>0。该反应的ΔS>0,根据△G=△H-T△S可知,在较高温度下能自发进行,故答案为:大于;较高温度;
(2)物质的量为2mol、体积为1L的乙苯蒸气发生催化脱氢反应
参加反应的乙苯为1.6mol,则:
![]() (g)
(g) ![]()
![]() (g)+H2(g)
(g)+H2(g)
开始(mol):n 0 0
转化(mol):1.61.6 1.6
平衡(mol):0.4 1.6 1.6
维持体系总压强p恒定,在温度T时,由PV=nRT可知,混合气体总浓度不变,设反应后的体积为V′,则![]() =
=![]() ,故V′=1.8L,平衡常数K=
,故V′=1.8L,平衡常数K=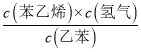 =
=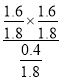 =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(3)v(H2)= ![]() =0.25 mol·L-1·min-1,根据方程式有v(
=0.25 mol·L-1·min-1,根据方程式有v(![]() )=v(H2)=
)=v(H2)= ![]() =0.25 mol·L-1·min-1,平衡时乙苯、苯乙烯、氢气的浓度分别为0.5mol/L,0.5mol/L,0.5mol/L,平衡常数为
=0.25 mol·L-1·min-1,平衡时乙苯、苯乙烯、氢气的浓度分别为0.5mol/L,0.5mol/L,0.5mol/L,平衡常数为![]() =0.5,维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,Qc=
=0.5,维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,Qc=![]() =0.5=K,平衡不移动,v正=v逆,故答案为:0.25 mol·L-1·min-1;等于;
=0.5=K,平衡不移动,v正=v逆,故答案为:0.25 mol·L-1·min-1;等于;
(4)
故答案为:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动;
②600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大,故选择600℃左右,故答案为:600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大;
(5)燃料电池是以乙苯为燃料,Li2CO3与K2CO3混合的碳酸盐为电解质的高温型燃料电池,燃料在负极发生氧化反应,电极反应![]() -42e-+21CO32-=5H2O+29CO2,正极是通入氧气、二氧化碳发生还原反应,故答案为:
-42e-+21CO32-=5H2O+29CO2,正极是通入氧气、二氧化碳发生还原反应,故答案为:![]() -42e-+21CO32-=5H2O+29CO2;O2(或空气)、CO2。
-42e-+21CO32-=5H2O+29CO2;O2(或空气)、CO2。

【题目】碳酸锂广泛应用于化工、冶金等行业。工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如下:
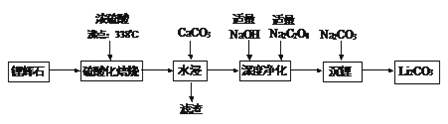
已知:①CaC2O4难溶于水
②Li2CO3的溶解度(g/L)
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
请回答下列问题:
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为___________。
(2)硫酸化焙烧温度不宜超过300℃,主要原因是___________________;焙烧中硫酸用量控制在理论用量的115%左右,硫酸加入过多的副作用是____________。
(3)“深度净化”时,加入适量Na2C2O4的目的是__________________。
(4)“沉锂”需要在95℃以上进行,主要原因是____________________________。
(5)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________,宜选用_____(“阳”或“阴”)离子交换膜。
②b中,生成Li2CO3反应的化学方程式是________________________。