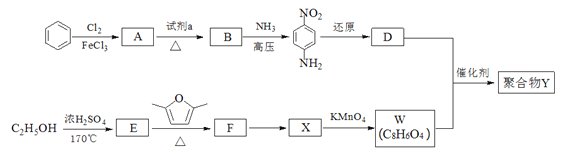
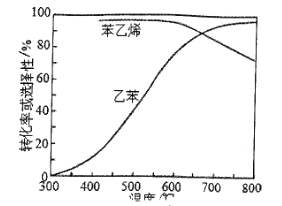
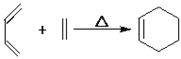题目内容
【题目】NA表示阿伏伽德罗常数。下列说法正确的是
A. 标准状况下 11.2L NT3分子中所含中子数为6.5NA
B. 电解2mol/L的NaCl溶液转移的电子数为2 NA
C. l00mL含A13+离子数为0.4NA的Al2(SO4)3溶液的物质的量浓度为2.0molL-1
D. 常温常压下,7.8g苯分子中含有的碳碳双键数目为0.3NA
【答案】A
【解析】A. 标准状况下, 11.2L NT3分子的物质的量为![]() =0.5mol,其中所含中子为0.5mol×(7+2×3)=6.5mol,故A正确;B. 未注明溶液的体积,无法判断电解2mol/L的NaCl溶液转移的电子数,故B错误;C. 铝离子要水解,l00mL含A13+离子数为0.4NA的Al2(SO4)3溶液的物质的量浓度大于2.0molL-1,故C错误;D.苯分子中没有碳碳双键,故D错误;故选A。
=0.5mol,其中所含中子为0.5mol×(7+2×3)=6.5mol,故A正确;B. 未注明溶液的体积,无法判断电解2mol/L的NaCl溶液转移的电子数,故B错误;C. 铝离子要水解,l00mL含A13+离子数为0.4NA的Al2(SO4)3溶液的物质的量浓度大于2.0molL-1,故C错误;D.苯分子中没有碳碳双键,故D错误;故选A。

【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是_____________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是______________________________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是____________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是____________,c中加入的试剂是____________,d中加入的试剂是____________,实验现象为____________________________________________。有同学认为,该实验装置仍不能证明上述结论,改进的措施是_________________________________________。