题目内容
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
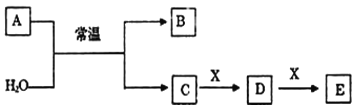
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___。
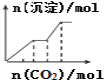
(2)若A为淡黄色粉末,X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种稀溶液,可选择的试剂为___(填代号)。
A.盐酸 B.BaCl2溶液 C.Ca(OH)2溶液
(3)若A为非金属氧化物,B为气体,遇空气会变红棕色,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式___。
【答案】OH-+HSO3-=SO32-+H2O AB 3NO2+H2O=2HNO3+NO
【解析】
(1)若A为常见的金属单质,焰色反应呈黄色,应为Na,X能使品红溶液褪色,应为SO2,则B为H2,C为NaOH,D为Na2SO3,E为NaHSO3;
(2)若A为淡黄色粉末,应为Na2O2;若X为一种最常见的造成温室效应的气体,应为二氧化碳;
(3)若A为非金属氧化物,B为气体,遇空气会变红棕色,则可推知B为NO,A为NO2,又X是Fe,由转化关系可知C具有强氧化性,则C为HNO3,E为Fe(NO3)2,据此分析作答。
(1)根据上述分析可知,A为Na,X为SO2,则B为H2,C为NaOH,D为Na2SO3,E为NaHSO3,C和E反应的离子方程式为OH-+HSO3-=SO32-+H2O;
(2)①若A为淡黄色粉末,应为Na2O2,若X为一种造成温室效应的气体,应为CO2,则C为NaOH,D为Na2CO3,E为NaHCO3,鉴别等浓度的碳酸钠与碳酸氢钠两种溶液,可用盐酸或氯化钡溶液,AB项正确,氢氧化钙溶液与两者均会反应生成白色沉淀,不能鉴别,C项错误;故答案为:AB;
(3)根据上述分析可知,NO2与水反应的方程式为3NO2+H2O=2HNO3+NO。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如下图所示。
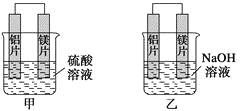
(1)写出甲池中正极的电极反应式:
正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极:_____________________________________________________。
总反应的离子方程式:________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?(____)
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
B.镁的金属性不一定比铝的金属性强 |
C.该实验说明金属活动顺序表已过时,已没有实用价值 |
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
(5)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_____________________________________________(如可靠,此空可不填)。
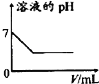
【题目】向两份等体积、等浓度,pH不同的FeSO4,溶液中逐滴加入NaClO溶液,实验测得溶液pH随加入NaClO溶液体积变化曲线如下图,实验现象如下表。下列说法不正确的是()
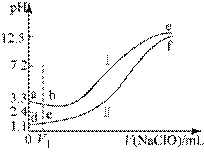
实验 | 实验现象 |
Ⅰ | 滴入V1mL NaClO溶液产生大量红褪色沉淀 |
Ⅱ | 滴入V1mL NaClO溶液,溶液变黄,未见沉淀,继续滴加出现红褪色沉淀 |
A.a~b段主要反应的离子方程式为:![]()
B.d~e段主要反应的离子方程式为:![]()
C.c、f点pH接近的主要原因是:![]()
D.向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出