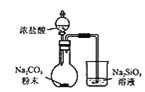
题目内容
【题目】取10g碳酸钙高温加热一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%,则下列判断正确的是
A.生成了2g二氧化碳B.剩余固体质量为5g
C.生成了5.6g氧化钙D.剩余碳酸钙的质量为8g
【答案】A
【解析】
原碳酸钙10g中的钙元素质量为:10g×![]() ×100%=4g,反应前后钙元素质量不变,则剩余固体中钙元素质量仍为4g,则含钙50%的剩余固体质量=
×100%=4g,反应前后钙元素质量不变,则剩余固体中钙元素质量仍为4g,则含钙50%的剩余固体质量=![]() =8g,根据质量守恒定律,反应生成二氧化碳的质量=10g-8g=2g,设生成的氧化钙质量是x,
=8g,根据质量守恒定律,反应生成二氧化碳的质量=10g-8g=2g,设生成的氧化钙质量是x,
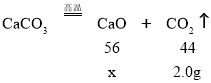
![]() =
=![]() ,x=2.56g,
,x=2.56g,
A.根据上述计算分析,生成了2g二氧化碳,故A正确;
B.根据上述计算分析,剩余固体质量为8g,故B错误;
C.根据上述计算分析,生成了2.56g氧化钙,故C错误;
D.根据上述计算分析,剩余碳酸钙的质量小于8g,故D错误;
答案选A。

练习册系列答案
相关题目
【题目】下列根据实验现象得出的结论正确的是![]()
选项 | 实验操作 | 现象 | 结论 |
A | 废 | 得到澄清溶液 | X中一定不含 |
B | 浓度均为 | 产生黑色沉淀 |
|
C |
| 试纸变为蓝色 |
|
D |
| 有机相呈橙色 | 氧化性: |
A.AB.BC.CD.D
【题目】金属钨用途广泛,H2还原WO3可得到钨,其总反应为:WO3+3H2![]() W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
温度(℃) | 25℃~550℃~600℃~700℃ |
主要成分 | WO3 W2O5 WO2 W |
A.1:1:4B.1:1:3C.1:1:2D.1:1:1