题目内容
将铁粉和铜粉的均匀混合物,平均分成四等分,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 mL | 200 mL | 300 mL | 400 mL |
| 剩余金属/g | 18.0 g | 9.6 g | 0 | 0 |
| NO体积/L | 2.24 L | 4.48 L | 6.72 L | V |
经化学定量分析,下列推断正确的是( )
A.①中溶解了5.6g Fe B.硝酸的浓度为4mol/L
C.②中溶解了9.6g Cu D.④中V=6.72 L
B
解析试题分析:A、铁的金属性强于铜,所以稀硝酸首先氧化单质铁,然后再氧化单质铜。实验①②中金属均过量,所以铁的氧化产物是硝酸亚铁。实验②比实验①多溶解了18.0g-9.6g=8.4g金属,而还原产物NO多了4.48L-2.24L=2.24L,物质的量是0.1mol,转移0.1mol×(5-2)=0.3mol。所以8.4g金属也转移0.3mol电子,因此金属的相对原子质量=8.4÷(0.3÷2)=56,这说明溶解的金属恰好是铁,因此实验①中也恰好溶解了8.4g铁,A不正确;B、实验①中生成硝酸亚铁0.15mol,NO是0.1mol,实验根据氮原子守恒可知,参加反应的硝酸是0.15mol×2+0.1mol=0.4mol,所以稀硝酸的浓度是0.4mol÷0.1L=4mol/L、B正确;C、②中溶解了8.4g×2=16.8g铁,C不正确;D、实验③比实验②多溶解了9.6g金属,多生成的NO是6.72L-4.48L=2.24L,物质的量是0.1mol,转移0.1mol×(5-2)=0.3mol。如果9.6g金属恰好是铜,则转移电子是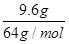 ×2=0.3mol,这说明9.6g金属就是铜。由于溶液中含有Fe2+,所以继续加入硝酸或继续产生NO,④中V>6.72 L所以选项D不正确,答案选B。
×2=0.3mol,这说明9.6g金属就是铜。由于溶液中含有Fe2+,所以继续加入硝酸或继续产生NO,④中V>6.72 L所以选项D不正确,答案选B。
考点:考查金属铁和铜的混合物与稀硝酸反应的有关计算和判断

化学科学需要借助化学专用语言来描述。下列有关化学用语表示正确的是
A.丙烷的球棍模型: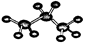 |
B.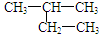 的名称:2-乙基丙烷 的名称:2-乙基丙烷 |
| C.乙酸的分子式:CH3COOH |
| D.氧化钠的化学式:Na2O2 |
下列化学用语表示正确的是
| A.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)= 2H2O(1)△H= -571.6 kJ/mol |
B.肥皂(主要成分为RCOONa)的水溶液显碱性:RCOO一+H2O RCOOH+OH- RCOOH+OH- |
C.实验室制氯气的离子方程式:MnO2+4H++4Cl-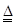 MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
D.乙酸与乙醇反应的化学方程式:CH3CO18OH+C2H5OH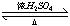 CH3CO18OC2H5+H2O CH3CO18OC2H5+H2O |
称取两份铝粉,第一份中加入足量的盐酸,第二份中加入足量的烧碱,若同温同压下放出相同体积的气体,则两份铝粉的质量比为
| A.2∶3 | B.1∶6 | C.3∶2 | D.1∶1 |
设NA为阿伏加德罗常数的值。下列说法一定正确的是
| A.25℃,pH=13的NaOH溶液中含有OH-为0.1 NA |
| B.1 L 0.1 mol·L-1 CuSO4溶液中含有Cu2+为0.1 NA |
| C.2.24LN2和NH3混合气体中原子间含有的共用电子对数目为0.3NA |
| D.2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
一定量的锌与100mL18.5mol?L﹣1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6L.将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol?L﹣1.则生成的气体中SO2和H2的体积比为( )
| A.1:2 | B.2:1 | C.1:4 | D.4:1 |
NA为阿伏伽德罗常数,下列叙述错误的是( )
| A.1mol乙醇中含有C—H键的数目为6 NA |
| B.46gNO2和N2O4混合气体中含有原子总数为3NA |
| C.足量Na 与1 mol O2反应,,转移电子可能为4NA个 |
D.常温下,1L 0.1 0mol.L-1的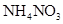 溶液中氮原子数为0.2 溶液中氮原子数为0.2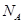 |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.1 molCH4分子中共价键总数为NA |
| B.水的摩尔质量就是NA个水分子的质量之和 |
| C.含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
设NA为阿伏加德罗常数的值,下列判断正确的是
| A.1 mol·L-1 FeCl3溶液,含有Fe3+的数目为NA个 |
| B.标准状况下,22.4L辛烷中分子数目为NA个 |
| C.0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA个 |
| D.氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 |