题目内容
13.将装有氮气和二氧化氮混合气体的试管倒立于水中,经足够时间后,试管内气体体积缩小为原体积的$\frac{3}{5}$,求:(1)原混合气体中氮气和二氧化氮气体的体积比.
(2)若上述气体是标准状况,求硝酸的物质的量浓度(若假设生成的溶质不向外扩散)
分析 (1)设原混合物的体积为1L,则反应后气体为0.6L,发生反应3NO2+H2O=2HNO3+NO,利用差量法计算V(NO2),进而计算V(N2),据此解答;
(2)根据c=$\frac{n}{V}$进行计算.
解答 解:(1)设原混合物的体积为1L,反应后气体为0.6L,则:
3NO2+H2O=2HNO3+NO 体积减少
3 1 3-1=2
V(NO2) 1L-0.6L=0.4L
所以,V(NO2)=$\frac{0.4L×3}{2}$=0.6L,则V(N2)=1L-0.6L=0.4L
故:V(N2):V(NO2)=0.4L:0.6L=2:3,答:原混合气体中氮气和二氧化氮气体的体积比2:3;
(2)设原气体体积为VL,而氮气和二氧化氮气体的体积比2:3;所以二氧化氮的体积为:$\frac{3}{5}V$,标况下物质的量为:$\frac{\frac{3}{5}V}{22.4}$mol,则生成硝酸的物质的量为:
$\frac{2}{3}×\frac{\frac{3}{5}V}{22.4}$mol,所以硝酸的物质的量浓度为:$\frac{\frac{\frac{2}{5}V}{22.4}}{\frac{2}{5}V}$=$\frac{1}{22.4}$mol/L,答:硝酸的物质的量浓度为$\frac{1}{22.4}$mol/L.
点评 本题考查混合物的有关计算,难度中等,利用赋值法可以减少计算量,注意差量法的应用.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
4.某烯烃氢化后得到的饱和烃如下:CH3- CH2-CH2-
CH2-CH2-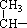 CH3,该烃可能的结构有( )
CH3,该烃可能的结构有( )
 CH2-CH2-
CH2-CH2-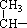 CH3,该烃可能的结构有( )
CH3,该烃可能的结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
1.下列操作不能在氧化铝坩埚中进行的是( )
| A. | 加热NH4HCO3 | B. | 加热Fe(OH)3 | C. | 加热NaOH | D. | 加热CaCO3 |
18.下列说法正确的是( )
| A. | 硫酸亚铁与氢氧化钠溶液混合生成氢氧化亚铁和硫酸钠的反应属于氧化还原反应 | |
| B. | Fe0与一氧化碳反应得到单质铁属于置换反应 | |
| C. | 在自然界中不存在铁单质 | |
| D. | 炽热的铁丝在充满氧气的集气瓶中发生化合反应 |
9.强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如图:
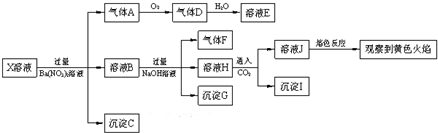
下列结论正确的是( )

下列结论正确的是( )
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F在足量氧气中经催化氧化不可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是Fe2+、SO32-、K+和C1- |
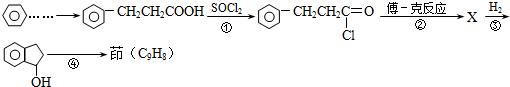
10.从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分: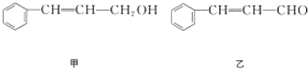
丙
已知:RCH═CHR′$→_{ii,Zn/H_{2}O}^{i,O_{2}}$RCHO+R′CHO;2HCHO$→_{ii,H+}^{i,浓NaOH}$HCOOH+CH3OH,由乙制丙的一种合成路线图如图(A~F均为有机物,图中Mr表示相对分子质量):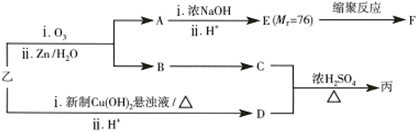
(1)试写出甲在一定条件下发生聚合反应的化学方程式: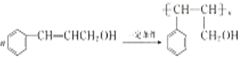 .
.
(2)下列物质不能与C反应的是③(选填序号).
①金属钠 ②HBr ③Na2CO3溶液 ④乙酸
(3)写出F的结构简式: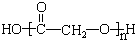 .
.
(4)D有多种同分异构体,任写其中一种能同时满足下列条件的异构体的结构简式: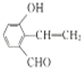 .
.
a.苯环上连接着三种不同官能团 b.能发生银镜反应 c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
(5)综上分析,丙的结构简式为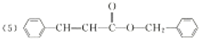 .
.
.

| 分子式 | C14H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
已知:RCH═CHR′$→_{ii,Zn/H_{2}O}^{i,O_{2}}$RCHO+R′CHO;2HCHO$→_{ii,H+}^{i,浓NaOH}$HCOOH+CH3OH,由乙制丙的一种合成路线图如图(A~F均为有机物,图中Mr表示相对分子质量):

(1)试写出甲在一定条件下发生聚合反应的化学方程式:
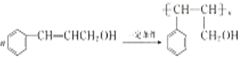 .
.(2)下列物质不能与C反应的是③(选填序号).
①金属钠 ②HBr ③Na2CO3溶液 ④乙酸
(3)写出F的结构简式:
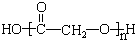 .
.(4)D有多种同分异构体,任写其中一种能同时满足下列条件的异构体的结构简式:
 .
.a.苯环上连接着三种不同官能团 b.能发生银镜反应 c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
(5)综上分析,丙的结构简式为
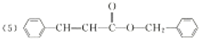 .
..

 .
.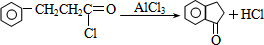 .
.