题目内容
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是( )
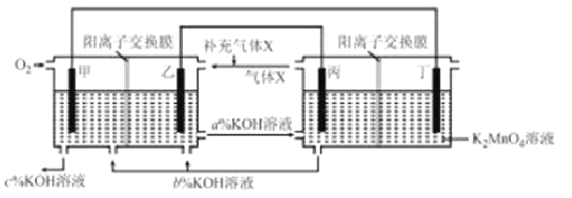
A. 电极丁的反应式为MnO42--e-= MnO4-
B. 电极乙附近溶液的pH减小
C. KOH溶液的质量分数:c%>a%>b%
D. 导线中流过2 mol电子时,理论上有2mol K+ 移入阴极区
【答案】C
【解析】A、在燃料电池中,氧气作正极,所以通入空气的极是正极,电极丁是阳极,锰酸根离子失去电子转化为高锰酸根,电极反应式为:MnO42--e-= MnO4-,A正确;B、通入燃料的极是负极,电极乙是负极,丙电极是阴极,氢原子的氢离子放电产生氢气,氢气在负极发生失去电子的氧化反应,电极反应式为H2-2e-+2OH-=2H2O,因此电极乙附近溶液的pH减小,B正确;C、燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即c%大于b%,负极消耗氢氧根离子,所以b%>a%,得到c%>b%>a%,C错误;D、导线中有2 mol电子通过时,理论上阴极就生成2molOH-,需有2 mol K+移入阴极区,D正确,答案选C。

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目

