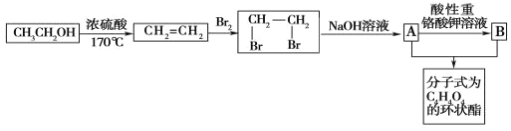
题目内容
【题目】下列实验装置正确的是( )
A. 实验室制乙烯B.
实验室制乙烯B. 酯化反应
酯化反应
C. 实验室制取Cl2D.
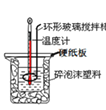
实验室制取Cl2D.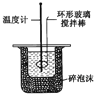 中和热的测定
中和热的测定
【答案】D
【解析】
A. 实验室制取乙烯需要170℃,温度计测量温度为溶液温度;
B. 酯化反应中导气管不能伸入饱和碳酸钠溶液中;
C. 制取氯气时,尾气处理应该防止倒吸现象;
D. 中和热测定中,温度计测量混合溶液温度,用环形玻璃棒搅拌溶液。
A. 实验室制取乙烯需要170℃,温度计要测量溶液温度,所以温度计应该插入溶液中,A错误;
B. 酯化反应中导气管不能伸入饱和碳酸钠溶液中,否则会产生倒吸现象,B错误;
C. 制取氯气时,尾气处理应该要防止倒吸,尾气处理装置中应该有倒置的漏斗,C错误;
D. 中和热测定中,温度计测量混合溶液温度,用环形玻璃棒搅拌溶液,使溶液温度混合均匀,符合实验条件,D正确;
故合理选项是D。

【题目】温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
编号 | 浓度/(mol·L-1) | 浓度/(mol·L-1) | 液的 pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=11 |
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?___________
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:____________________
(3)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式表示):c(Na+)-c(A-)=______mol·L-1。
(4)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:H2B=H++HB- HB-![]() H++B2-
H++B2-
在0.1 mol·L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1 B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(H+)=c(OH-)+c(HB-)