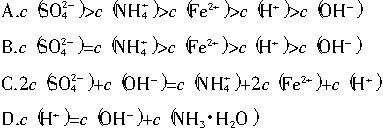题目内容
莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,在0.1mol/L的该盐的溶液中,下列有关比较不正确的是( )
A.c(SO![]() )> c(NH
)> c(NH![]() )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.c(NH3·H2O)+c(NH![]() )= 0.2mol/L
)= 0.2mol/L
C.c(H+)= c(OH-)+c(NH3·H2O)
D.2 c(SO![]() )+ c(OH-)= c(NH
)+ c(OH-)= c(NH![]() )+2 c(Fe2+)+c(H+)
)+2 c(Fe2+)+c(H+)
C
解析:
由电荷守恒原理知D正确;由物料守恒知B正确;由质子守恒原理:c(H+)= c(OH-)+c(NH3·H2O)+c[Fe(OH)2]。

练习册系列答案
相关题目

 【实验化学】
【实验化学】