��Ŀ����
����Ŀ��һ���¶��£���һ�������ı������ˮϡ�����У���Һ�ĵ��������仯��ͼ��ʾ���й�˵����ȷ���ǣ� ��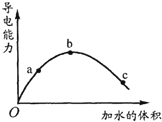
A.a��b��c������Һ��pH��a��b��c
B.��ʹC��� c(CH3COO-)������Һ��pHҲ���ɼ���������CH3COONa����
C.a��b��c������Һ��1mol/L����������Һ�кͣ���������������Һ�����a��b��c
D.��ʪ���pH��ֽ����c����Һ��pHֵ����ʵ��pHֵƫС
���𰸡�B
��������A��һ���¶��£���һ�������ı������ˮϡ�����У�������CH3COOHH++CH3COO����ϵ�����������Ϣ����ͼ����Һ�ĵ�����Ϊ����ˮ�����ӣ���Һ�ĵ���������ǿ���������˵����ˮϡ�����У�������Һ�����ӵ�Ũ�������Ӻ��С�����a��b��c�������ӵ�Ũ�ȴ�СΪ��c��b����c��a����c��c�������a��b��c������Һ��pH�Ĵ�С��ϵΪ��c��a��b����A����
B������CH3COOHH++CH3COO��ƽ�⣬������Һ�м���������CH3COONa����ʱ��������
CH3COONa�TNa++CH3COO�� �� ʹ��Һ��CH3COO����Ũ�����ӣ�ƽ�������ƶ���ʹ������Ũ�ȼ�С����Һ��pH����B��ȷ��
C�����������Һ�м���1mol/L����������Һʱ������CH3COOH+NaOH�TCH3COONa+H2O����Ӧ�����ʵ����йأ�����ȡ�����ѵ��������Ũ�ȣ�����Һ�д�������ʵ����̶���������ĵ��������Ƶ����ʵ�����ͬ����C����
D������pH������Һ��pHʱ�������ʹ֮ʪ���൱�ڽ���Һϡ���ˣ���ʹ��Һ�������ӵ�Ũ�ȼ�С��pH����D����
��ѡB��
�����㾫����������Ҫ���������������ˮ��Һ�еĵ���ƽ������֪ʶ�㣬��Ҫ���յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ��������ȷ�����⣮