题目内容
某矿石由前20号元素中的四种组成,其化学式为WYZX4。X、Y、Z、W分布在三个周期,且 原子序数依次增大,Y、Z处于相邻主族,Y、W为金届元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。则下列判断正确的是
| A.Y、Z的氧化物都有两性 |
| B.气态氢化物的稳定性:Z>X |
| C.原子半径:W>Y>Z>X |
| D.最高价氧化物对应水化物的碱性:W<Y |
C
原子序数X<Y<Z<W且为前20号元素分布在三个周期,由题意可知X元素为O元素,Y、Z为第三周期元素,W为第四周期元素。若W为K元素,则Y、Z最外层电子数之和等于7,可得Y元素为AL元素、Z元素为Si元素;若W为Ca元素,则Y、Z最外层电子数之和等于8不符合题意。所以A错,因为AL2O3为两性氧化物,而SiO2不是两性氧化物。B错,O元素的非金属性比Si元素非金属性强,氢化物稳定性更强。C对,根据电子层数越多半径越大,同一周期从左到右半径越小。D错,最高价氧化物对应的水化物碱性强弱与元素的金属性强弱有关,由于K元素金属性比AL元素金属性强。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

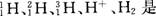
 常用做为示踪原子
常用做为示踪原子