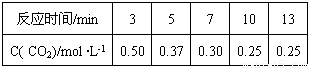
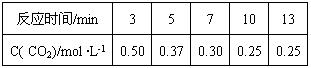
题目内容
元素X、Y、Z、W位于元素周期表中前四周期,原子序数依次增大.其相关信息如表:
请回答:
(1)W的基态原子核外电子排布式是 .Y单质分子中含 个π键,试比较Y与同周期相邻的两种元素的第一电离能大小关系 > > .(填元素符号)
(2)X与Z形成的最简单的化合物是一种优良的溶剂,它是由 (填“极性”、“非极性”) 键构成的 (填“极性”、“非极性”)分子
(3)一定条件下Z与Y可形成YZ3,YZ3与水反应可生成一种弱酸和一种弱碱,试写出该反应的方程式 .
(4)X所形成的一种晶体具有高硬度、高熔点特性,属于 (填“分子”、“原子”或“离子”)晶体,该晶体结构中X-X-X键角为 .
| 元素 | 相 关 信 息 |
| X | 基态原子核外有三个能级,每个能级的电子数都相等 |
| Y | Y与Z不在同一周期,其原子核外未成对电子数比电子层数多1 |
| Z | 可与W形成两种化合物,且水溶液均呈酸性 |
| W | 是地壳中质量百分含量第二的金属元素 |
(1)W的基态原子核外电子排布式是
(2)X与Z形成的最简单的化合物是一种优良的溶剂,它是由
(3)一定条件下Z与Y可形成YZ3,YZ3与水反应可生成一种弱酸和一种弱碱,试写出该反应的方程式
(4)X所形成的一种晶体具有高硬度、高熔点特性,属于
分析:元素X、Y、Z、W位于元素周期表中前四周期,原子序数依次增大.X基态原子核外有三个能级,每个能级的电子数都相等,则其核外电子排布式为1s22s22p2,故X为碳元素;W是地壳中质量百分含量第二的金属元素,则W为Fe元素;Z可与W形成两种化合物,且水溶液均呈酸性,则Z为Cl;Y与Z不在同一周期,结合原子序数可知,Y处于第二周期,Y原子核外未成对电子数比电子层数多1,则未成对电子数为3,故其核外电子排布式为1s22s22p3,则Y为氮元素,据此解答.
解答:解:元素X、Y、Z、W位于元素周期表中前四周期,原子序数依次增大.X基态原子核外有三个能级,每个能级的电子数都相等,则其核外电子排布式为1s22s22p2,故X为碳元素;W是地壳中质量百分含量第二的金属元素,则W为Fe元素;Z可与W形成两种化合物,且水溶液均呈酸性,则Z为Cl;Y与Z不在同一周期,结合原子序数可知,Y处于第二周期,Y原子核外未成对电子数比电子层数多1,则未成对电子数为3,故其核外电子排布式为1s22s22p3,则Y为氮元素,
(1)W为Fe,原子核外有26个电子,其基态原子核外电子排布式是1s22s22p63s23p63d64s2.Y单质分子为N2,分子中形成N≡N三键,含2个π键.同周期自左而右元素第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故元素第一电离能N>O>C,
故答案为:1s22s22p63s23p63d64s2;2;N;O;C;
(2)C与Cl形成的最简单的化合物是一种优良的溶剂为CCl4,为正四面体对称结构,是由极性键构成的非极性分子,
故答案为:极性;非极性;
(3)NCl3与水反应可生成一种弱酸和一种弱碱,生成NH3?H2O与HClO,反应方程式为NCl3+4H2O=NH3?H2O+3HClO,
故答案为:NCl3+4H2O=NH3?H2O+3HClO;
(4)C元素所形成的一种晶体具有高硬度、高熔点特性,属于原子晶体,该晶体结构每个C原子与周围4个C原子形成正四面体结构,C-C键角为109°28′,
故答案为:原子;109°28′.
(1)W为Fe,原子核外有26个电子,其基态原子核外电子排布式是1s22s22p63s23p63d64s2.Y单质分子为N2,分子中形成N≡N三键,含2个π键.同周期自左而右元素第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故元素第一电离能N>O>C,
故答案为:1s22s22p63s23p63d64s2;2;N;O;C;
(2)C与Cl形成的最简单的化合物是一种优良的溶剂为CCl4,为正四面体对称结构,是由极性键构成的非极性分子,
故答案为:极性;非极性;
(3)NCl3与水反应可生成一种弱酸和一种弱碱,生成NH3?H2O与HClO,反应方程式为NCl3+4H2O=NH3?H2O+3HClO,
故答案为:NCl3+4H2O=NH3?H2O+3HClO;
(4)C元素所形成的一种晶体具有高硬度、高熔点特性,属于原子晶体,该晶体结构每个C原子与周围4个C原子形成正四面体结构,C-C键角为109°28′,
故答案为:原子;109°28′.
点评:本题考查结构位置性质关系应用,涉及核外电子排布、电离能、分子结构与性质、晶体类型与结构等,难度中等,(3)中注意根据信息推断,实质发生水解反应.

练习册系列答案
相关题目
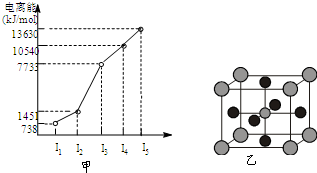 有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.
有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn. CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)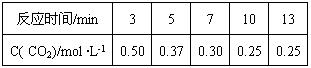
 CH3OH(g)
+H2O(g)
CH3OH(g)
+H2O(g)