题目内容
14.下列物质的性质比较中正确的是( )| A. | 键的极性:H2O>H2S | B. | 导电性:HF溶液<HCl溶液 | ||
| C. | 燃烧热:△H(C)(s,石墨)>△H(CO)(g) | D. | 耐腐蚀性:铝<生铁 |
分析 A.形成共价键的两种元素的非金属性差别越大,则形成的共价键的极性越大;
B.溶液的导电性与离子浓度有关;
C.燃烧反应的△H为负值;
D.Al的表面能形成致密的氧化膜,Fe能形成疏松的氧化膜.
解答 解:A.形成共价键的两种元素的非金属性差别越大,则形成的共价键的极性越大,已知非金属性:O>S,则键的极性:H2O>H2S,故A正确;
B.溶液的导电性与离子浓度有关,不能确定HF和HCl中离子浓度的大小关系,所以不能确定HF溶液与HCl溶液的导电性强弱,故B错误;
C.燃烧反应的△H为负值,1molC燃烧放出的热量大于1molCO燃烧放出的热量,所以燃烧热:△H(C)(s,石墨)<△H(CO)(g),故C错误;
D.Al的表面能形成致密的氧化膜,能保护内部金属不被极性氧化,而Fe形成疏松的氧化膜,不能保护内部金属,所以耐腐蚀性:铝>生铁,故D错误.
故选A.
点评 本题考查了化学键的极性、溶液的导电性、反应热的比较、金属的腐蚀,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
相关题目
5.下列应用中,主要利用物质氧化性的是( )
| A. | 用烟道气中和碱性废水 | B. | 重铬酸钾用于酒驾检査 | ||
| C. | 用苯酚制造酚醛树脂 | D. | 金属加工前用硫酸酸洗 |
2.某学习小组的同学在学习了化学反应速率与化学平衡知识后,对反应:aA(g)+bB(g)?cC(g)+dD(g)△H,反应特点与对应的图象展开了讨论,其中不正确的是( )
| A. | 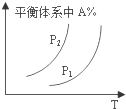 图中,若P1>P2,则该反应在较低温度下有利于自发进行 | |
| B. |  图中,若T2>T1,则△H<0且a+b=c+d | |
| C. | 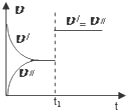 图中(v′表示正反应速率,v″表示逆反应速率),t1时刻改变的条件一定是使用了催化剂 | |
| D. | 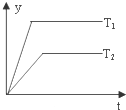 图中,若△H<0,则纵坐标不可能表示的是反应物的转化率 |
19.化学无处不在,下列说法正确的是( )
| A. | 工业上制取玻璃的工艺是应用了物质酸性的差异 | |
| B. | 家庭里可用淀粉检验加碘盐是否含有碘 | |
| C. | 铁是人体必需的微量元素,所以可以适当地吃点铁锈 | |
| D. | 王水是由浓盐酸和浓硝酸两种物质按3:1的体积比混合配制成的 |
6. 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
(1)已知2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
H2O(g)=H2O(1)△H=-44.0kJ/mol
甲醇不完全燃烧生成气态水的热化学方程式为2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1
若不完全燃烧20g甲醇生成液态水,此时放出的热量为333.5kJ
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
计算上述反应的焓变△H=(2d+6b-3a-c-3e)kJ/mol(用相应字母表示),若只加压,则平衡常数K不变(选填“增大”,“减小”或“不变”);
(3)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
下列关系正确的是AD
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1molCH2OH,则放出(Q1+Q3)kJ热量
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH2OH,达到平衡时测得混合气体的密度是同温同压下起始密度的1.6倍,则达平衡前v(正)>v(逆)(填“>”、“<”或“=”);
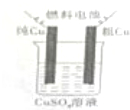
(5)甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加3.2g(粗铜中杂质不参与电极反应).
①请写出燃料电池中的负极反应式:CH3OH-6e-+8OH-=CO32-+6H2O
②燃料电池正极消耗空气的体积是2.8L(标准状态,空气中O2体积分数以20%计算).
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)已知2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
H2O(g)=H2O(1)△H=-44.0kJ/mol
甲醇不完全燃烧生成气态水的热化学方程式为2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1
若不完全燃烧20g甲醇生成液态水,此时放出的热量为333.5kJ
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | a | b | c | d | e |
(3)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH2OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1molCH2OH,则放出(Q1+Q3)kJ热量
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH2OH,达到平衡时测得混合气体的密度是同温同压下起始密度的1.6倍,则达平衡前v(正)>v(逆)(填“>”、“<”或“=”);
(5)甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加3.2g(粗铜中杂质不参与电极反应).
①请写出燃料电池中的负极反应式:CH3OH-6e-+8OH-=CO32-+6H2O
②燃料电池正极消耗空气的体积是2.8L(标准状态,空气中O2体积分数以20%计算).
3.下列实验目的能实现的是( )
| A. |  实验室制取乙炔 | B. | 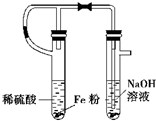 实验室制取Fe(OH)2 | ||
| C. |  实验室制取少量氨气 | D. | 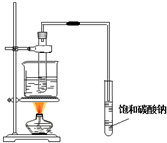 实验室制取乙酸丁酯 |
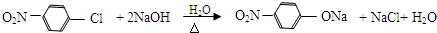
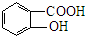 .
.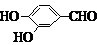 、
、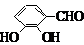 、
、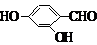 、
、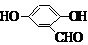 (其中三种)(写出3种).
(其中三种)(写出3种). 2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题:
2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题:
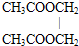
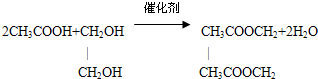 .
.