题目内容
如图所示三套实验装置,分别回答下列问题。
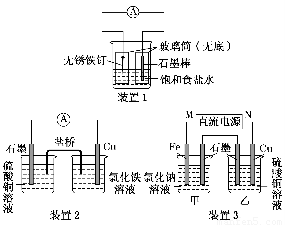
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀,表明铁被________(填“氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应式为________________________________________________________________________。
(2)装置2中的石墨是________极(填“正”或“负”),该装置发生的总反应的离子方程式为________________________________________________________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为________极;甲烧杯中铁电极的电极反应式为_________________。
②乙烧杯中电解反应的离子方程式为_________________________________。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体标准状况下的体积为________mL。
(1)氧化 O2+4e-+2H2O=4OH- (2)正 2Fe3++Cu=2Fe2++Cu2+
(3)①正 Fe-2e-=Fe2+ ②2Cu2++2H2O 2Cu+O2↑+4H+ ③224
2Cu+O2↑+4H+ ③224
【解析】(1)装置1,由石墨棒附近的溶液变红可知,石墨棒作正极,电极反应式为O2+4e-+2H2O=4OH-,铁钉作负极,发生氧化反应。
(2)由装置2两电极活泼性强弱得Cu一定是负极,总反应的离子方程式即该装置中自发的氧化还原反应:2Fe3++Cu=2Fe2++Cu2+。
(3)①由甲中石墨电极附近首先变红可知该极H+放电,即该极为阴极,Fe为阳极,电极反应式为Fe-2e-=Fe2+,由此可知,电源M端为正极;
②电源M端为正极,N端为负极,乙中Cu为阴极,石墨为阳极,发生反应的离子方程式为2Cu2++2H2O 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③由两池中的对应关系Cu~2e-~H2↑
? 64 g? 1 mol
? 0.64 g? 0.01 mol
即224 mL H2。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
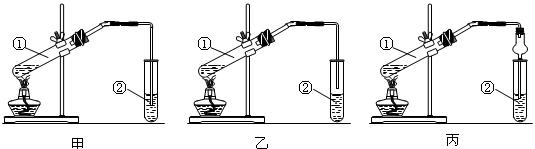 请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是 (选填“甲”或“乙”)。丙同学设计了丙装置,用球形干燥管代替玻璃管,除了起到冷凝作用外,另一重要作用是 。
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是 (选填“甲”或“乙”)。丙同学设计了丙装置,用球形干燥管代替玻璃管,除了起到冷凝作用外,另一重要作用是 。 请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是
(选填“甲”或“乙”)。丙同学设计了丙装置,用球形干燥管代替玻璃管,除了起到冷凝作用外,另一重要作用是
。
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是
(选填“甲”或“乙”)。丙同学设计了丙装置,用球形干燥管代替玻璃管,除了起到冷凝作用外,另一重要作用是
。