题目内容
某无色溶液含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32—、⑥SO42—中的
若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
(1) | 用pH试纸检验 | 溶液的pH大于7 |
(2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
(3) | 向所得水溶液中加入Ba(NO3)2溶液和稀硝酸 | 有白色沉淀产生 |
(4) | 过滤,向滤液中加入AgNO3溶液和稀硝酸 | 有白色沉淀产生 |
下列结论正确的是( )
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑥
C.不能确定的离子是①
D.不能确定的离子是③⑤
A
【解析】由实验步骤(1)该溶液的pH大于7,说明含有强碱弱酸盐,一定有①⑤,无②Ba2+;由(2)可知一定有④Br-,(3)说明生成硫酸钡沉淀,⑤SO32—也可被氧化成硫酸根,无法判断;因(2)加入氯水,故(4)无法证明原溶液中是否含有③Cl-。

 口算题天天练系列答案
口算题天天练系列答案溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
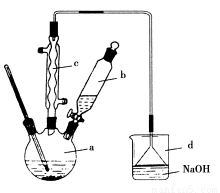
| 苯 | 溴 | 溴苯 |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是____________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
A.重结晶 B.过滤C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25 mL B.50 mLC.250 mL D.500 mL
