题目内容
11.下列条件的离子反应方程式不正确的是( )| A. | 向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| B. | FeBr2溶液中通入等物质的量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | KMnO4溶液中加H2O2,紫色褪去:2MnO4-+H2O2+6H+═2Mn2++3O2↑+4H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
分析 A.反应生成氢氧化镁、碳酸钠和水;
B.由电子守恒可知,等物质的量时亚铁离子全部被氧化,溴离子一半被氧化;
C.电子不守恒;
D.反应生成硫酸钠、氢氧化铜、氧气.
解答 解:A.向Mg(HCO3)2溶液中加入过量的 NaOH溶液的离子反应为Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O,故A正确;
B.FeBr2溶液中通入等物质的量Cl2的离子反应为2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故B正确;
C.KMnO4溶液中加入H2O2,紫色褪去的离子反应为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故C错误;
D.向CuSO4溶液中加入Na2O2的离子反应为2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑,故D正确;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
2.在溶液中加入足量的Na2O2后仍能大量共存的是( )
| A. | NH4+、NO3-、Ba2+、Cl- | B. | K+、SO42-、Cl-、AlO2- | ||
| C. | NO3-、HCO3-、Ca2+、Mg2+ | D. | Cl-、Na+、CO32-、SO32- |
16.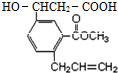 某有机物的结构简式如图所示,该有机物可能发生的反应是( )
某有机物的结构简式如图所示,该有机物可能发生的反应是( )
①酯化反应;②银镜反应;③加成反应;④取代反应;⑤氧化反应;⑥加聚反应;⑦缩聚反应;⑧水解反应.
 某有机物的结构简式如图所示,该有机物可能发生的反应是( )
某有机物的结构简式如图所示,该有机物可能发生的反应是( )①酯化反应;②银镜反应;③加成反应;④取代反应;⑤氧化反应;⑥加聚反应;⑦缩聚反应;⑧水解反应.
| A. | ①③④⑤⑥⑦⑧ | B. | ①②③④⑤⑥⑧ | C. | ①②③⑥⑧ | D. | ①③④⑤⑥⑧ |
3.化学与生产、生活、环境密切相关.下列有关说法中不正确的是( )
| A. | 燃煤时加入适量生石灰,可减少废气中SO2的排放量 | |
| B. | 氨是制造硝酸、铵盐和纯碱的原料 | |
| C. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| D. | SiC俗称金刚砂,可用作砂纸、砂轮的磨料 |
20.下列分子中划横线的原子采取的杂化方式为sp杂化的是( )
| A. | CH4 | B. | C2H4 | C. | C2H2 | D. | NH3 |
1.水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14.则下列叙述正确的是( )
| A. | 水的电离是一个放热过程 | |
| B. | 35℃时,c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的盐酸中由水电离产生的c(OH-)=1.0×10-3mol/L | |
| D. | 25℃时,向溶液中加入稀氨水,平衡逆向移动,Kw不变 |
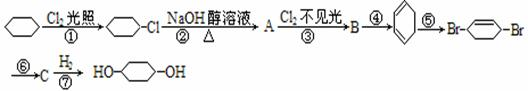
 ;C:
;C: ;
;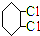 .
. 3,3,4,6-四甲基辛烷
3,3,4,6-四甲基辛烷 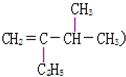 3-甲基-2-乙基-1-丁烯
3-甲基-2-乙基-1-丁烯  2,6-二甲基乙苯.
2,6-二甲基乙苯.