题目内容
5.发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成.某小组为探究不同品牌的发酵粉的化学成分,进行如下实验.【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由臭粉和明矾组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:

(2)结合步骤①~③分析,气体A为氨气(或NH3),该发酵粉的成分为NaHCO3 和NH4HCO3(填化学式).
(3)乙品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证.实验仪器和用品任选,限选试剂:稀盐酸、0.1mol/LNaOH溶液写出实验步骤、预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后,将溶 液分成两份,分别装入A、B试管中. | |
| 步骤2:用洁净的铂丝蘸取A中的溶液,在酒精灯火焰上灼烧,观察焰色 | 焰色呈黄色证明有Na+,发酵粉中有NaHCO3 |
| 步骤3:向B试管中逐滴滴加0.1mol/L NaOH溶液 | 看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解),证明发酵粉中有明矾. |
分析 (1)可由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成,三种物质分有了两种物质组合,剩下的就是臭粉和明矾组成一组;
(2)与碱反应生成的气体是氨气,且该物质必含铵根离子,故含有臭粉(碳酸氢铵),加热分解后的物质和盐酸反应生成气体,应含有小苏打(碳酸氢钠);
(3)利用焰色反应检验溶液中钠离子,确定含有碳酸氢钠;铝离子的物质与碱反应生成沉淀后沉淀溶解,据此检验铝离子,确定含有硫酸铝钾.
解答 解:(1)由信息可知该物质可由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成,题中有2种了,剩下的就是由臭粉和明矾组成,
故答案为:臭粉和明矾;
(2)与碱反应生成的气体A是氨气,且该物质必含铵根离子,故含有臭粉(碳酸氢铵),加热分解后的物质和盐酸反应生成气体,应含有小苏打(碳酸氢钠),综上所述,该发酵粉的成分为NaHCO3和NH4HCO3,
故答案为:氨气(或NH3); NaHCO3 和NH4HCO3;
(3)步骤2:用洁净的铂丝蘸取A中的溶液,在酒精灯火焰上灼烧,观察焰色;焰色呈黄色证明有Na+,发酵粉中有NaHCO3;
步骤3:向B试管中逐滴滴加0.1mol/L NaOH溶液;看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解),证明发酵粉中有明矾;
故答案为:
| 实验步骤 | 预期现象和结论 |
| 步骤2:用洁净的铂丝蘸取A中的溶液,在酒精灯火焰上灼烧,观察焰色 | 焰色呈黄色 |
| 步骤3:向B试管中逐滴滴加0.1mol/L NaOH溶液 | 看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解) |
点评 本题考查实验探究物质的组成成分、猜想与事实验证、Na+检验方法、钠铝重要化合物及铵盐的性质等,本题考查的为实验探究题,解这类题的关键,就是抓住题给的信息,认真分析来完成题目,本题难度中等.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
16.实验室常利用甲醛法测定某(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH${\;}_{4}^{+}$+6HCHO=4H++(CH2)6N4+6H2O,然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤1.用电子天平准确称取样品1.5000g.
步骤2.将样品溶解并冷却后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤3.移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点.重复步骤③操作2次.
(1)根据步骤3填空:
①下列操作可导致结果偏高的是BC.
A.读取滴定终点时NaOH溶液的体积时俯视刻度线
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
②滴定时边滴边摇动锥形瓶,眼睛应观察.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
③滴定达到终点时,溶液由无色色变为粉红(或浅红)色,且半分钟内不褪色.
④配制样品溶液及滴定实验中所需的玻璃仪器除烧杯、250mL容量瓶、锥形瓶、量筒、滴定管外,还有玻璃棒、胶头滴管.(填仪器名称)
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1000mol•L-1,则该样品中氮的质量分数为18.76%.(保留两位小数)
步骤1.用电子天平准确称取样品1.5000g.
步骤2.将样品溶解并冷却后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤3.移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点.重复步骤③操作2次.
(1)根据步骤3填空:
①下列操作可导致结果偏高的是BC.
A.读取滴定终点时NaOH溶液的体积时俯视刻度线
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
②滴定时边滴边摇动锥形瓶,眼睛应观察.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
③滴定达到终点时,溶液由无色色变为粉红(或浅红)色,且半分钟内不褪色.
④配制样品溶液及滴定实验中所需的玻璃仪器除烧杯、250mL容量瓶、锥形瓶、量筒、滴定管外,还有玻璃棒、胶头滴管.(填仪器名称)
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 1.00 | 21.00 |
| 3 | 25.00 | 1.20 | 21.21 |
20.下列关于Fe( OH)3胶体的说法中,不正确的是( )
| A. | 分散质粒子直径在10-9~l0-7m之间 | B. | 是一种纯净物 | ||
| C. | 具有丁达尔效应 | D. | 具有净水作用 |
15.下列说法中错误的是( )
| A. | 若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 | |
| C. | CO2与SiO2晶体熔化时,所克服的微粒间相互作用不同 | |
| D. | 短周期元素离子aXn-和bYm-具有相同的电子层结构,若a>b,则n>m |
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖. .
.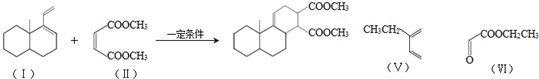
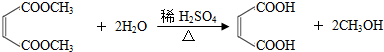 .
.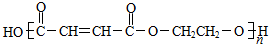 .
.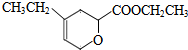 、
、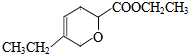 .
.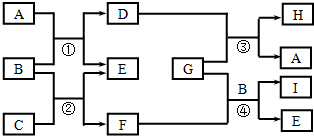 如图转化关系图(反应条件均略去)中A、C、E、G均为单质,其中A、C、G为金属;E为气体;B为无色液体;A、G在冷的浓硫酸溶液中均发生钝化;F、I溶液的焰色均为黄色.
如图转化关系图(反应条件均略去)中A、C、E、G均为单质,其中A、C、G为金属;E为气体;B为无色液体;A、G在冷的浓硫酸溶液中均发生钝化;F、I溶液的焰色均为黄色.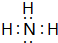 ,结构式为
,结构式为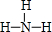 ,写出D的气态氢化物在催化剂存在下跟氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,写出D的气态氢化物在催化剂存在下跟氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O. .
.