题目内容
15.下列说法中错误的是( )| A. | 若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 | |
| C. | CO2与SiO2晶体熔化时,所克服的微粒间相互作用不同 | |
| D. | 短周期元素离子aXn-和bYm-具有相同的电子层结构,若a>b,则n>m |
分析 A、若XY4分子中X原子处于正四面体的中心,则正负电荷中心重合;
B、分子间存在氢键使物质的熔沸点异常的高;
C、原子晶体熔化时克服共价键,分子晶体熔化时克服分子间作用力;
D、X、Y得电子后具有相同的电子层结构,质子数大的得电子少.
解答 解:A、若XY4分子中X原子处于正四面体的中心,则正负电荷中心重合,所以XY4分子为非极性分子,故A正确;
B、分子间存在氢键使物质的熔沸点异常的高,而C2H5OH分子间存在氢键,所以C2H5OH的氟点比C2H5Br高,故B正确;
C、二氧化硅属于原子晶体,原子晶体熔化时克服共价键,二氧化碳属于分子晶体,分子晶体熔化时克服分子间作用力,所克服的微粒间相互作用不同,故C正确;
D、X、Y得电子后具有相同的电子层结构,质子数大的得电子少,若a>b,则n<m,故D错误;
故选D.
点评 本题考查分子的极性、氢键、配位键和电子层结构,综合性强,但比较容易.

练习册系列答案
相关题目
5.发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成.某小组为探究不同品牌的发酵粉的化学成分,进行如下实验.
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由臭粉和明矾组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:

(2)结合步骤①~③分析,气体A为氨气(或NH3),该发酵粉的成分为NaHCO3 和NH4HCO3(填化学式).
(3)乙品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证.实验仪器和用品任选,限选试剂:稀盐酸、0.1mol/LNaOH溶液写出实验步骤、预期现象和结论.
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由臭粉和明矾组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:

(2)结合步骤①~③分析,气体A为氨气(或NH3),该发酵粉的成分为NaHCO3 和NH4HCO3(填化学式).
(3)乙品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证.实验仪器和用品任选,限选试剂:稀盐酸、0.1mol/LNaOH溶液写出实验步骤、预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后,将溶 液分成两份,分别装入A、B试管中. | |
| 步骤2:用洁净的铂丝蘸取A中的溶液,在酒精灯火焰上灼烧,观察焰色 | 焰色呈黄色证明有Na+,发酵粉中有NaHCO3 |
| 步骤3:向B试管中逐滴滴加0.1mol/L NaOH溶液 | 看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解),证明发酵粉中有明矾. |
6.某有机物的分子结构如下: ,关于它的性质叙述中不正确的是( )
,关于它的性质叙述中不正确的是( )
 ,关于它的性质叙述中不正确的是( )
,关于它的性质叙述中不正确的是( )| A. | 酸性条件下可发生水解反应,且产物只有一种 | |
| B. | 1mol该有机物最多可跟8molNaOH反应 | |
| C. | 1mol该有机物最多可跟2molBr2反应 | |
| D. | 该有机物可跟NaHCO3溶液反应 |
3.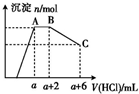 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示.已知:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,下列结论不正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示.已知:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,下列结论不正确的是( )
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示.已知:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,下列结论不正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示.已知:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,下列结论不正确的是( )| A. | 原混合溶液中一定含有的离子是OH-、CO32-、AlO2-、SiO32-、Al3+ | |
| B. | AB段反应的离子方程式是H++CO32-═HCO3-,H++HCO3-═CO2↑+H2O | |
| C. | AB段之前反应的离子方程式是AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| D. | K+、Na+两种离子肯定存在其中一种 |
10.乳酸橙花酯是一种食用香料,其结构如图所示.下列关于该物质的说法不正确的是( )


| A. | 1 mol该化合物最多可与2 mol H2反应 | |
| B. | 该化合物能与乳酸发生酯化反应 | |
| C. | 该化合物能与氢氧化钠溶液、溴水反应 | |
| D. | 该化合物的同分异构体可能为芳香族化合物 |
20.关于符号ZAX2+的判断不正确的是( )
| A. | 它可以表示一个阳离子 | B. | X表示元素的符号 | ||
| C. | Z表示质子数,A则表示质量数 | D. | 此微粒含有电子总数为Z+2 |
4.下列关于化学用语的表示正确的是( )
| A. | 氢氧化钠的电子式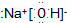 | |
| B. | 质子数为29、中子数为35的铜原子${:}_{29}^{35}$Cu | |
| C. | 氯离子的结构示意图: | |
| D. | 对苯二酚的结构简式: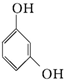 |