题目内容
17.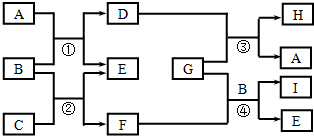 如图转化关系图(反应条件均略去)中A、C、E、G均为单质,其中A、C、G为金属;E为气体;B为无色液体;A、G在冷的浓硫酸溶液中均发生钝化;F、I溶液的焰色均为黄色.
如图转化关系图(反应条件均略去)中A、C、E、G均为单质,其中A、C、G为金属;E为气体;B为无色液体;A、G在冷的浓硫酸溶液中均发生钝化;F、I溶液的焰色均为黄色.(1)反应①的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
(2)反应④的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)反应③后所得A中含有少量物质G和H,除去A中这两种杂质的方法是加入足量NaOH溶液反应后过滤.
(4)日常生活中G的制品比A的制品耐腐蚀的原因是Al表面会生成致密的氧化膜,防止内部的Al进一步被氧化.
分析 A、G在冷的浓硫酸溶液中均发生钝化,则A、G为Al、Fe,G与D反应生成H和A,则A为Al,G为Fe,D为铁的氧化物,H为Al2O3,B为无色液体,B为H2O,所以D为Fe3O4,E为4H2,F、I溶液的焰色均为黄色,则F、I中含有钠元素,C为金属,所以C为Na,F为NaOH,铝与氢氧化钠的水溶液反应生成I和E,所以I为NaAlO2,据此答题.
解答 解:A、G在冷的浓硫酸溶液中均发生钝化,则A、G为Al、Fe,G与D反应生成H和A,则A为Al,G为Fe,D为铁的氧化物,H为Al2O3,B为无色液体,B为H2O,所以D为Fe3O4,E为4H2,F、I溶液的焰色均为黄色,则F、I中含有钠元素,C为金属,所以C为Na,F为NaOH,铝与氢氧化钠的水溶液反应生成I和E,所以I为NaAlO2,
(1)反应①为铁与水蒸汽反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4+4H2;
(2)反应④的离子方程式为 2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)反应③后所得 Fe中含有少量物质Al和Al2O3,其中Al和Al2O3能和氢氧化钠反应,而铁不反应,所以除去A中这两种杂质的方法是 加入足量NaOH溶液反应后过滤,
故答案为:加入足量NaOH溶液反应后过滤;
(4)日常生活中铝的制品比铁的制品耐腐蚀的原因是在常温下Al表面会生成致密的氧化膜,防止内部的Al进一步被氧化,而铁不能,
故答案为:Al表面会生成致密的氧化膜,防止内部的Al进一步被氧化.
点评 本题考查无机物的推断,转化中特殊反应、物质的颜色、状态等是推断突破口,需要学生熟练掌握元素化合物知识,难度中等.

| A. | 燃烧反应 | B. | 取代反应 | C. | 硝化反应 | D. | 加成反应 |
| A. | Mg2+、NH${\;}_{4}^{+}$、OH-、SO${\;}_{4}^{2-}$ | B. | Na+、H+、Cl-、HCO${\;}_{3}^{-}$ | ||
| C. | Na+、K+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$ | D. | H++、K+、MnO${\;}_{4}^{-}$、SO${\;}_{3}^{2-}$ |
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由臭粉和明矾组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:

(2)结合步骤①~③分析,气体A为氨气(或NH3),该发酵粉的成分为NaHCO3 和NH4HCO3(填化学式).
(3)乙品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证.实验仪器和用品任选,限选试剂:稀盐酸、0.1mol/LNaOH溶液写出实验步骤、预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后,将溶 液分成两份,分别装入A、B试管中. | |
| 步骤2:用洁净的铂丝蘸取A中的溶液,在酒精灯火焰上灼烧,观察焰色 | 焰色呈黄色证明有Na+,发酵粉中有NaHCO3 |
| 步骤3:向B试管中逐滴滴加0.1mol/L NaOH溶液 | 看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解),证明发酵粉中有明矾. |
| A. | 打开啤酒瓶盖后有大量泡沫溢出 | |
| B. | 实验室用排饱和食盐水的方法收集氯气 | |
| C. | 热的纯碱去油污能力更强 | |
| D. | 夏天将食品储藏在冰箱中 |
| A. | B、C、D形成的简单离子半径大小顺序Cm+>Dn+>Bx-(m+、n+、x-表示所带电荷) | |
| B. | A、B、E气态氢化物稳定性为E>A>B | |
| C. | C和D的最高价氧化物对应的水化物之间可以发生反应 | |
| D. | E单质是制备太阳能电池的重要材料是因为E的单质导电性强 |
 ,关于它的性质叙述中不正确的是( )
,关于它的性质叙述中不正确的是( )| A. | 酸性条件下可发生水解反应,且产物只有一种 | |
| B. | 1mol该有机物最多可跟8molNaOH反应 | |
| C. | 1mol该有机物最多可跟2molBr2反应 | |
| D. | 该有机物可跟NaHCO3溶液反应 |


 .
. .
. .
.