题目内容
【题目】某研究性学习小组用浓度为0.20mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。

(1)准确量取一定体积的待测液需要使用的仪器是______________。
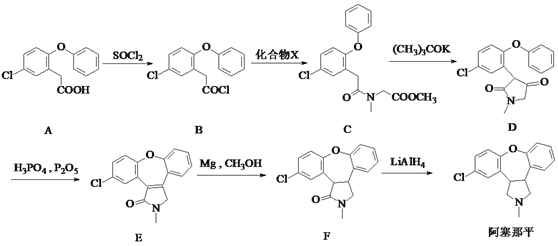
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
【答案】 碱式滴定管(或移液管) 26.10 滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不恢复红色 80% ab
【解析】本题考查滴定实验,(1)因为是准确量取一定体积的待测液,因此应用滴定管或移液管,滴定管和移液管的精确度是0.01mL,样品是烧碱,使用滴定管时,应选择碱式滴定管;(2)根据图,开始时刻度为0,滴定终点后刻度为26.10mL,因此消耗盐酸标准液体积为26.10mL;(3)说明滴定达到终点:滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不恢复红色;(4)三次消耗的盐酸的体积分别为19.9、20.10、20.00,三次平均消耗盐酸的体积为(19.9+20.10+20.00)/3mL=20.00mL,盐酸与氢氧化钠发生NaOH+HCl=NaCl+H2O,n(NaOH)=n(HCl)=20.00×10-3×0.2mol=4×10-4mol,250mL溶液中n(NaOH)=4×10-4×250/10mol=0.1mol,其质量为0.1×40g=4g,则纯度为4/5.0×100%=80%;(5)根据c(NaOH)=c(HCl)×V(HCl)/V(NaOH),a、部分标准液滴出锥形瓶,造成消耗V(HCl)增大,即所测氢氧化钠的浓度偏大,故a正确;b、用待测液润洗锥形瓶,造成锥形瓶中溶质物质的量增大,即消耗V(HCl)增大,即所测浓度偏高,故b正确;c、锥形瓶中是否有水,对实验无影响,故c错误;d、放出碱液的滴定管开始有气泡,放出液体后气泡消失,造成锥形瓶中待测液的体积减小,消耗盐酸体积减小,即所测溶液的浓度偏小,故d错误。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案