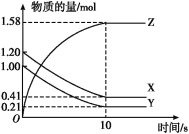
题目内容
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
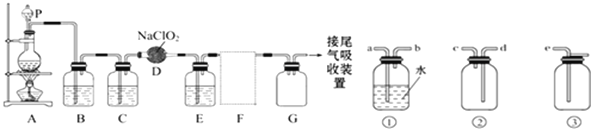
(1) 为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2) (设为装置A) 称重,记为m1g。将样品装入石英玻璃管中,再次将装置A 称重,记为m2g。按下图连接好装置进行实验。
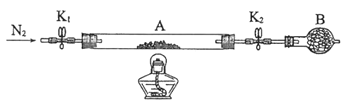
①将下列实验操作步骤正确排序________(填标号) ;重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
②根据实验记录,计算绿矾化学式中结晶水数目x=_______(列式表示)。若实验时按a、d 次序操作,则使x_____(填“偏大”“偏小”或“无影响”)。
(2) 为探究硫酸亚铁的分解产物,将(1) 中已恒重的装置A 接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
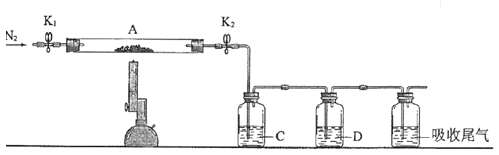
①C、D 中的溶液依次为________(填标号)。C、D中有气泡冒出,并观察到的现象分别是_____。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_______________。
【答案】 dabfce ![]() 偏小 c、a 产生白色沉淀、品红溶液褪色 2FeSO4
偏小 c、a 产生白色沉淀、品红溶液褪色 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】(1)①实验时,为避免亚铁被氧化,应先通入氮气,冷却时注意关闭开关,防止氧气进入,冷却至室温再称量固体质量的变化,则正确的顺序为dabfce,故答案为:dabfce;
②直至A恒重,记为m3g,应为FeSO4和装置的质量,则m(FeSO4)=(m3-m1)g,m(H2O)=(m2-m3)g,则n(H2O)== ![]() mol、n(FeSO4)=
mol、n(FeSO4)= ![]() =
=![]() mol,结晶水的数目等于
mol,结晶水的数目等于![]() =
=![]() ,若实验时按a、d次序操作,会导致硫酸亚铁被氧化,则导致固体质量偏大,测定结果偏小,故答案为:
,若实验时按a、d次序操作,会导致硫酸亚铁被氧化,则导致固体质量偏大,测定结果偏小,故答案为: ![]() ;偏小;
;偏小;
(2)①实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,S元素化合价应降低,则一定生成SO2,可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,可观察到产生白色沉淀,D为品红,可用于检验SO2,品红褪色,故答案为:c、a;产生白色沉淀、品红溶液褪色;
②硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,分解的化学方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4
Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。

【题目】某研究性学习小组用浓度为0.20mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。
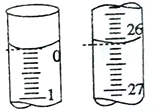
(1)准确量取一定体积的待测液需要使用的仪器是______________。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失