题目内容
在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,I为一常见金属,酸G是重要的化工产品和化工原料;固体H能够溶解在A溶液和酸G中,且H为良好的耐火材料(图中部分产物没有列出)。
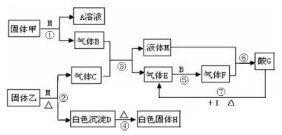
(1)固体甲与液体M反应的方程式为______。A溶液与固体H反应的离子方程式为______。
(2)固体乙的化学式为_______。液体M的电子式为_______。
(3)反应①~⑦中属于氧化还原反应的为_______(填写反应序号)。
(4)若I与C的稀溶液不反应,只能与G的浓溶液在加热条件下反应,则反应⑦的化学方程式为_______。
(5)若由黄铁矿(FeS2)与气体B反应来生产气体E,且每生成1 mol E放出426.5 kJ的热量,该反应的热化学方程式为_______ 。

(1)固体甲与液体M反应的方程式为______。A溶液与固体H反应的离子方程式为______。
(2)固体乙的化学式为_______。液体M的电子式为_______。
(3)反应①~⑦中属于氧化还原反应的为_______(填写反应序号)。
(4)若I与C的稀溶液不反应,只能与G的浓溶液在加热条件下反应,则反应⑦的化学方程式为_______。
(5)若由黄铁矿(FeS2)与气体B反应来生产气体E,且每生成1 mol E放出426.5 kJ的热量,该反应的热化学方程式为_______ 。
(1) 2Na2O2+2H2O="4NaOH+" O2↑; Al2O3+2OH-=2AlO2-+H2O
(2) Al2S3;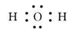 .
.
(3)①③⑤⑦
(4)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(5)4FeS2(s)+11O2(g) 2Fe2O3(s)+8 SO2(g) ΔH=-3412KJ/mol
2Fe2O3(s)+8 SO2(g) ΔH=-3412KJ/mol
(2) Al2S3;
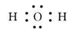 .
.(3)①③⑤⑦
(4)Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O (5)4FeS2(s)+11O2(g)
 2Fe2O3(s)+8 SO2(g) ΔH=-3412KJ/mol
2Fe2O3(s)+8 SO2(g) ΔH=-3412KJ/mol试题分析:固体甲焰色反应呈黄色说明含有Na元素,含有Na元素的化合物能够与常见的液体物质反应放出气体,则固体甲为Na2O2,液体M为水,A为NaOH,气体B 为O2,为反应的方程式为2Na2O2+ 2H2O="4NaOH+" O2↑; O2能够与某气体C发生反应产生H2O和气体E,证明C中含有H元素,E还能与O2继续发生反应,说明C、E、F 含有相同的元素,C、E有强还原性,能连续被氧化。可能C为H2S;E为SO2;F为SO3。那么酸G为H2SO4。I为一常见金属,与稀H2SO4溶液不反应,只能与H2SO4浓溶液在加热条件下反应,证明该金属I为Cu。固体H能够溶解在A溶液和酸G中,且H为良好的耐火材料,则H为Al2O3.逆推白色沉淀D为Al(OH)3.能与水反应产生Al(OH)3和H2S的固体物质乙为Al2S3.反应的方程式为Al2S3+ 6H2O= 2Al(OH)3↓+3H2S↑. (l)固体甲与液体M反应的方程式为2Na2O2+2H2O="4NaOH+" O2↑;A溶液与固体H反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.(2)Al2S3;(2)固体乙的化学式为Al2S3;液体M的电子式为
 。(3)氧化还原反应的特征是化合价的升降,在①~⑦反应中属于氧化还原反应的为①③⑤⑦。(4)Cu与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)
。(3)氧化还原反应的特征是化合价的升降,在①~⑦反应中属于氧化还原反应的为①③⑤⑦。(4)Cu与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O 。(5) FeS2燃烧的化学方程式为4FeS2+11O2
CuSO4+SO2↑+2H2O 。(5) FeS2燃烧的化学方程式为4FeS2+11O2 2Fe2O3+8SO2。由于在该反应中产生了8mol的SO2气体,所以该反应的热化学方程式为4FeS2(s)+11O2(g)
2Fe2O3+8SO2。由于在该反应中产生了8mol的SO2气体,所以该反应的热化学方程式为4FeS2(s)+11O2(g)  2Fe2O3(s)+8 SO2(g) ΔH=-3412KJ/mol。
2Fe2O3(s)+8 SO2(g) ΔH=-3412KJ/mol。
练习册系列答案
相关题目