��Ŀ����
����Ŀ����ͭ��(CuFeS2)����ȡͭ���仯�������Ҫԭ��֮һ�������Ʊ������Ļ����
��1��ұ��ͭ�ķ�ӦΪ��8CuFeS2��21O2=8Cu��4FeO��2Fe2O3��16SO2����CuFeS2��Fe�Ļ��ϼ�Ϊ��2����Ӧ�б���ԭ��Ԫ����________����Ԫ�ط�����������Ӧ�������˱����22.4L���壬ת�Ƶĵ�����ĿΪ________��
��2������ұ�����̲�����������������SO2��Ϊ������Ⱦ��֮һ�����д��������к�������________�����������
a���߿��ŷ� b����Ũ������������������
c����NaOH��Һ������Na2SO3 d���ð�ˮ�����Ƶ������
��3�����������(K2S2O8)����ǿ�����ԣ��ɽ�I������ΪI2��S2O![]() ��2I��=2SO
��2I��=2SO![]() ��I2��ͨ���ı䷴Ӧ;����Fe3����Fe2�����ɴ�������Ӧ���������ӷ���ʽ��ʾFe3����������Ӧ���Ĺ��̣�________��________��������ƽ����
��I2��ͨ���ı䷴Ӧ;����Fe3����Fe2�����ɴ�������Ӧ���������ӷ���ʽ��ʾFe3����������Ӧ���Ĺ��̣�________��________��������ƽ����
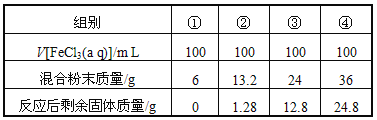
��4�����û�ͭ��ұ��ͭ������¯��(��Fe2O3��FeO��SiO2��Al2O3)���Ʊ�Fe2O3������Ϊ��
����ϡ�����ȡ¯�������ˣ�
����Һ���������ټ������NaOH��Һ�����ˣ�������ϴ�ӡ�������յ�Fe2O3.
��������Ϣ�ش��������⣺
a����ȥAl3�������ӷ���ʽ��________��
b��ѡ���ṩ���Լ������ʵ����֤¯���к���FeO.
�ṩ���Լ���ϡ���ᡡϡ���ᡡKSCN��Һ��KMnO4��Һ��NaOH��Һ����ˮ ��ѡ�Լ�Ϊ________��֤��¯���к���FeO��ʵ������Ϊ____________________________________��
���𰸡� Cu��O 6.25NA cd 2Fe3����2I��=2Fe2����I2�� S2O![]() ��2Fe2��=2SO
��2Fe2��=2SO![]() ��2Fe3�� Al3����4OH��=AlO
��2Fe3�� Al3����4OH��=AlO![]() ��2H2O ϡ���� KMnO4��Һ ϡ�����ȡ¯��������ҺʹKMnO4��Һ��ɫ
��2H2O ϡ���� KMnO4��Һ ϡ�����ȡ¯��������ҺʹKMnO4��Һ��ɫ
����������1��8CuFeS2��21O2=8Cu��4FeO��2Fe2O3��16SO2�У���CuFeS2��Fe�Ļ��ϼ�Ϊ��2��FeԪ�صĻ��ϼ����ߣ�Cu��OԪ�صĻ��ϼ۽��ͣ���Cu��OԪ�ر���ԭ���ɷ���ʽͭ��16�ۣ�����21��4�ۣ�ÿ����16molSO2,ת�ƣ�16+21��4��mol=100mol���ӣ�����Ӧ�������˱����22.4L���壬ת�Ƶĵ�����ĿΪ100mol/16mol��NA =6.25NA ����2��a���߿��ŷţ���Ȼ�ŷ��ڿ����У���a����b��SO2������Ũ������������b����c��SO2�������������NaOH��Һ������Na2SO3 ����c��ȷ��d��SO2�������������Ӧ�����κ�ˮ���ð�ˮ�����Ƶ�����Σ���d��ȷ����ѡcd����3�����������������ԣ��ܽ�������������S2O82���ܽ���������������ԭ��Ϊ��2Fe3��+2I��=2Fe2��+I2��S2O82��+2Fe2��=2SO42��+2Fe3����
��4��a��������������������ܺ�ǿ���Լ�ǿ�Ӧ��6H��+Al2O3=3H2O+2Al3������ȥ�����ӵķ�Ӧ�����ù�������������Һ�������ӷ�Ӧ�������ǻ���������ȥAl3�������ӷ���ʽ�� Al3����4OH��=AlO![]() ��2H2O��b�����������Һ�������������ӣ�ʹ�ø��������Һ��ɫ�������Լ���ϡ������KMnO4��Һ��֤��¯���к���FeO��ʵ������Ϊ��ϡ�����ȡ¯��������ҺʹKMnO4��Һ��ɫ��
��2H2O��b�����������Һ�������������ӣ�ʹ�ø��������Һ��ɫ�������Լ���ϡ������KMnO4��Һ��֤��¯���к���FeO��ʵ������Ϊ��ϡ�����ȡ¯��������ҺʹKMnO4��Һ��ɫ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�