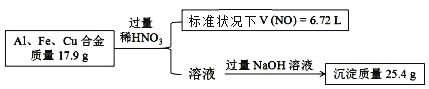
题目内容
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
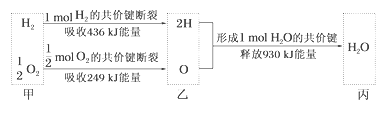
A. H2O分解为H2与O2时放出热量
B. 生成1mol H2O时吸收热量245 kJ
C. 甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D. 氢气和氧气的总能量小于水的能量
【答案】C
【解析】由图中信息可知,1mol H2断裂共价键变为2mol H要吸收436KJ的能量,0.5mol O2断裂共价键变为1mol O要吸收249KJ的能量,2mol H和1mol O结合成1mol H2O要放出930KJ的能量。因此,可以算出1mol H2和0.5mol O2反应生成1mol H2O要放出245KJ的能量,反过来,水分解为H2与O2时吸收热量。综上所述,C正确,本题选C。

【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9kJ | 390.8kJ | 192.8kJ | 945.8kJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是____。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是____mol/(Lmin);10秒末NH3的浓度是___mol/L;N2 的的物质的量___mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
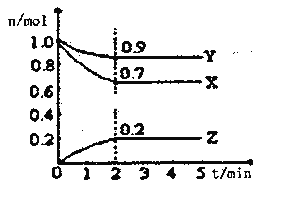
(1)该反应的化学方程式为___________
(2)从开始至2min,Z的平均反应速率为____________;
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量 C.减小压强 D.增加物质Z的物质的量. E.加入某种催化剂 F.缩小容积 G.使用效率更高的催化剂
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1—溴丁烷的反应如下:
NaBr+H2SO4HBr+NaHSO4 ①
R—OH+HBr![]() R—Br+H2O ②
R—Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备实验中,下列仪器最不可能用到的是________。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.长颈漏斗
(2)溴代烃的水溶性______(填“大于”、“等于”或“小于”)相应的醇,将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在______(填“上层”、“下层”或“不分层”)
(3)制备操作中,加入的浓硫酸必需进行稀释,其目的是____________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于______________ ;
但在制备1—溴丁烷时却不能边反应边蒸出产物,其原因是_______________________。
(6)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2后进行的实验操作是______(填字母)
a.分液 b.蒸馏 c.萃取 d.过滤
(7)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后______(按实验的操作顺序选填下列序号)①加热 ②加入AgNO3 ③加入稀HNO3 ④加入NaOH溶液.