题目内容
20.A、B、C、D、E是五种短周期主族元素,其中A是元素周期表中原子半径最小的元素;B是形成化合物种类最多的元素;C是地壳中含量最多的元素;D的气态氢化物的水溶液显碱性;E金属制成金属板后,经加工可制成一种高质量的反光镜,该金属粉末和氧化铁混合常用于焊接钢轨.(1)写出C、E的元素符号O、Al.
(2)B元素位于周期表中的位置为第二周期IVA族,BC2的电子式为
 (用元素符号表示).
(用元素符号表示).(3)A、B、C、D的原子半径由大到小的顺序为C>N>O>H(用元素符号表示).
(4)E的最高价氧化物对应的水化物与短周期元素中最高价氧化物对应水化物碱性最强的物质在溶液中反应
的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
分析 A、B、C、D、E是五种短周期主族元素,其中A是元素周期表中原子半径最小的元素,则A为H元素;B是形成化合物种类最多的元素,则B为碳元素;C是地壳中含量最多的元素,则C为O元素;D的气态氢化物的水溶液显碱性,则D为N元素;E金属制成金属板后,经加工可制成一种高质量的反光镜,该金属粉末和氧化铁混合常用于焊接钢轨,则E为Al,据此解答.
解答 解:A、B、C、D、E是五种短周期主族元素,其中A是元素周期表中原子半径最小的元素,则A为H元素;B是形成化合物种类最多的元素,则B为碳元素;C是地壳中含量最多的元素,则C为O元素;D的气态氢化物的水溶液显碱性,则D为N元素;E金属制成金属板后,经加工可制成一种高质量的反光镜,该金属粉末和氧化铁混合常用于焊接钢轨,则E为Al.
(1)C为O元素、E为Al元素,故答案为:O;Al;
(2)B为碳元素,位于周期表中的位置为:第二周期IVA族,CO2的电子式为 ,故答案为:第二周期IVA族;
,故答案为:第二周期IVA族; ;
;
(3)所有元素中H原子半径最小,同周期自左而右原子半径减小,故原子半径:C>N>O>H,故答案为:C>N>O>H;
(4)E的最高价氧化物对应的水化物为Al(OH)3,短周期元素中最高价氧化物对应水化物碱性最强的物质为NaOH,二者在溶液中反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查结构性质位置关系应用,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
10.据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中的Fe的化合价为+2,则被氧化的元素为Fe和CuFeS2中的S(填元素名称)
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4•5H2O):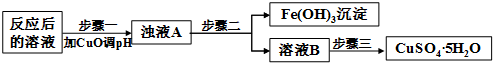
①分析下列表格(其中Ksp是相应金属氢氧化物的沉淀溶解平衡常数):
步骤一应调节溶液的pH范围是3.2≤pH<4.7,请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因加入CuO与H+反应使c(H+)减小,c(OH-)增大,使溶液中c(Fe3+)•c3(OH-)>Ksp[Fe(OH)3],导致Fe3+生成沉淀而除去
②步骤三中的具体操作方法是蒸发浓缩,冷却结晶
(3)工业上冶炼铜的方法之一为:
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-12kJ/mol
②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ/mol
③S(s)+O2(g)=SO2(g)△H=-296.8kJ/mol
则该法冶炼铜的反应中△H=-193.3kJ•mol-1.
(1)CuFeS2中的Fe的化合价为+2,则被氧化的元素为Fe和CuFeS2中的S(填元素名称)
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4•5H2O):

①分析下列表格(其中Ksp是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
②步骤三中的具体操作方法是蒸发浓缩,冷却结晶
(3)工业上冶炼铜的方法之一为:
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-12kJ/mol
②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ/mol
③S(s)+O2(g)=SO2(g)△H=-296.8kJ/mol
则该法冶炼铜的反应中△H=-193.3kJ•mol-1.
11.某温度下,在体积可变的密闭容器中,加入1molX(g)和3molY(g)发生反应达到平衡:X(g)+m Y(g)═3Z(g),在此平衡体系中加入3molZ(g),再次达到平衡后,X、Y、Z的体积分数不变.下列叙述不正确的是( )
| A. | m=3 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为原平衡的2倍 |
15.铝可以做成反光镜,这是利用了铝的( )
| A. | 具有金属光泽 | B. | 延展性 | C. | 导热性 | D. | 金属活泼性 |
12.下列选项与胶体知识无关的是( )
| A. | 在豆浆里加入盐卤做豆腐 | |
| B. | 水泥、冶金厂常用高压电除去工厂烟尘,以减少对空气污染 | |
| C. | 一束平行光线照射暗箱中的蛋白质溶液时,从侧面可以看到光亮的通路 | |
| D. | 氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体 |
9.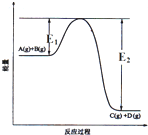 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )| A. | 该反应是吸热反应 | |
| B. | 当反应达到平衡时,升高温度,A的转化率增大 | |
| C. | 反应体系中加入催化剂对反应热没有影响 | |
| D. | 在反应体系中加催化剂,反应速率增大,E1、E2均减小 |
10.下列关于物质的类别的说法正确的是( )
| A. | 能在水溶液或熔融状态下导电的物质就是电解质 | |
| B. | 胶体区别于溶液的本质是因为能产生丁达尔效应 | |
| C. | 纯碱不属于碱,干冰属于酸性氧化物 | |
| D. | Na2O和Na2O2都能与水反应生成对应的碱,它们都是碱性氧化物 |