题目内容
某温度下,在一密闭容器中充入3molA和1molB进行如下反应:3A(g)+B(g)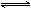 2C(g)+D(g),达平衡后A的转化率为x.
2C(g)+D(g),达平衡后A的转化率为x.
若改变下列条件:
(1)恒温恒容充入氦气,
(2)恒温恒压充入氦气.
判断在上述两种情况下平衡是否移动?若平衡发生移动,则达到新平衡后A的转化率如何改变?
答案:略
解析:
提示:
解析:
|
(1)恒温恒容时充入氦气,虽然反应体系总压强增大,但容器体积不变,A、B、C、D各物质的浓度均不变,正、逆反应速率不变,平衡不移动. (2)恒温恒压时充入氦气,要使压强保持不变,则容器的体积必然增大,平衡向逆反应方向移动,A的转化率减小. |
提示:
|
本题容易产生以下错解: (1)恒温恒容充入氦气,压强增大,平衡向正反应方向移动,A的转化率增大 (2)恒温恒压充入氦气,因压强不变,平衡不移动. 保持压强不变充入氦气,导致容器体积增大,各物质浓度同等倍数地减小,若不向容器中充入氦气,则只要减小外界压强同样可使容器体积增大,从而将恒温恒压充入氦气转换为减小压强,根据勒夏特列原理,平衡向气体体积扩大方向 (逆反应方向)移动,则A的转化率减小.引起容器内气体压强变化一般可分为三种情况: (1)在其他条件不变时,外界压强变化导致容器体积变化,该变化使反应体系中各气体的浓度同时且同等程度变化,此种情况可用勒夏特列原理判断. (2)通入与反应体系无关的气体,应注意在恒温恒容与恒温恒压时,对平衡移动的影响不同. |

练习册系列答案
相关题目
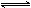 2C(g)+D(g),达平衡后A的转化率为x.
2C(g)+D(g),达平衡后A的转化率为x. C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )


 mol;
mol;

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)