题目内容
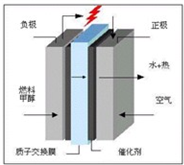
甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇。
(1)已知在常温常压下:

(2)工业上正在研究利用来生产甲醇燃料的方法,该反应为:

在某温度下,将6mol CO2和8molH2 充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%。请回答:
②用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH)=____.
②此温度下该反应平衡常数K=____________ mol;
mol;
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后H2的转化率____________75% (填“大于”、“小于”或“等于”)。
(3)一氧化碳与氢气也可以合成甲醇:
①若该反应在恒温恒容条件下进行,下列说法正确的是____;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50L2/mol2,反应到某时刻测得各组分的物质的量如下:

请比较此时正、逆反应速率的大小: (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(1)-1275.6 (2)① 0.125 mol/(L·min) ②0.5 ③小于 (3)① d e ② =
【解析】
试题分析:(1)将①×2+②-③×4得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH={-442.8×2-566-(-44) ×4}KJ/mol=-1275.6 KJ/mol.
(2)①V(H2)=ΔC(H2)/Δt={(8mol÷2L)×75%}÷8min= 0.375 mol/(L·mol); 3V(CH3OH)= V(H2),所以V(CH3OH)=1/3 V(H2)=0.375mol/(L·mol) ÷3= 0.125 mol/(L·min) . ②在反应开始时C(CO2)=3mol/L, C(H2)=4mol/L,C(CH3OH)=0,C(H2O)=0.当反应达到化学平衡时,C(CO2)=2mol/L, C(H2)=1mol/L, C(CH3OH) =1mol/L,C(H2O)=1mol/L. 此温度下该反应平衡常数K={ C(CH3OH)·C(H2O)} ÷ { C(CO2) · C(H2)}={1×1} ÷{2×1}=0.5.③当反应达到平衡后若再充入2mol H2,化学平衡正向移动,但平衡移动消耗的H2的物质的量远远小于投入量,所以 H2的转化率比75% 要小。即当可逆反应达到化学平衡时,加入反应物,能使其它反应物的转化率提高,但它本身的转化率反而降低。
(3)①a由于该反应是在恒温恒容条件下进行,无论反应是否达到平衡混合气体的密度不会发生改变。错误。b.反应达到平衡后,通入CH3OH(g), CH3OH(g)的浓度增大,平衡向左移动。错误。c.反应达到平衡后,通入氩气使压强增大,由于反应混合物个物质的浓度没变,所以平衡不移动。错误。d.反应达到平衡后,升高温度,化学平衡向吸热反应方向即平衡逆向移动,平衡常数减小。正确。e.若使用催化剂,会改变反应的途径,反应速率改变,但不能使化学平衡发生移动。正确。选项为:d e.
②在某时刻C(CO)=0.2mol/L,C(H2)=0.2mol/L,C(CH3OH)=0.4mol/L. C(CH3OH) ÷{ C(CO) ·C(H2)} = 0.4mol/L ÷(0.2mol/L×(0.2mol/L)2)= 50L2/mol2=K.所以反应达到化学平衡,此时V正=V逆
考点:考查外界条件对化学平衡的影响、平衡状态的判断、化学反应速率、化学平衡常数的计算、盖斯定律的应用等知识。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案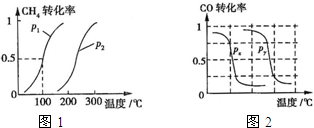 (2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.
(2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇. CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1
 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1= CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
 ⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
 CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
