题目内容
据科学家预测,月球的土壤中吸附着数百万吨的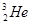 ,而在地球上氦元素则主要以
,而在地球上氦元素则主要以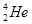 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A.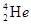 原子核内含有4个质子 原子核内含有4个质子 |
B.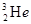 与 与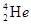 互为同位素 互为同位素 |
C.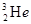 与 与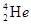 在元素周期表中占有不同的位置 在元素周期表中占有不同的位置 |
D.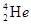 的最外层电子数为2,故 的最外层电子数为2,故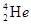 易失去最外层电子 易失去最外层电子 |
B
解析试题分析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,据此可知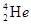 原子核内含有2个质子,A不正确;
原子核内含有2个质子,A不正确;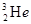 与
与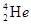 的质子数相同,而质子数不同,互为同位素,B正确;同位素在周期表中占有相同的位置,C不正确;质子数=核外电子数,则
的质子数相同,而质子数不同,互为同位素,B正确;同位素在周期表中占有相同的位置,C不正确;质子数=核外电子数,则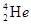 的最外层电子数为2,由于达到了稳定结构,所以难失去电子,D不正确,答案选B。
的最外层电子数为2,由于达到了稳定结构,所以难失去电子,D不正确,答案选B。
考点:考查原子组成以及组成原子的几种微粒之间的计算;同位素的判断以及性质等
点评:该题是高考中的常见题型,试题以核素为载体,重点考查学生对原子组成以及组成微粒之间数量关系、同位素判断的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案Q、W、X、Y、Z都是短周期元素。X、Y、Q在周期表中的位置关系如图。W、Z的最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是
| IA | IIA | IIIA | IVA |
| | | | Q |
| X | | Y | |
A.非金属性:W > Z
B.原子半径:X >Y > Z
C.最高价氧化物对应水化物的碱性:X > Y
D.氢化物稳定性:Q > W
短周期元素X、Y、Z、R在周期表中的位置如图。下列说法正确的是
| | | ||||
| | | X | Y | | |
| | | | Z | R | |
A.气态氢化物的稳定性:X > Y
B.原子半径大小:Y> Z
C.X和Y形成的化合物是离子化合物
D.Z、R的最高价氧化物对应的水化物都是强酸
X、Y、Z、W四种短周期主族元素原子半径依次减小,其中X、Y、Z位于同一周期,只有X为金属元素,X和Y最外层电子数差1,Y和Z的核电荷数差3,Z与W最外层电子数相同。下列说法正确的是
| A.Y与W形成的化合物一定含有离子键 |
| B.W的氢化物沸点一定大于Z的氢化物沸点 |
C.若形成化合物YZ4,则YZ4的电子式为 |
| D.若形成化合物XZ3,则XZ3中所有原子均满足最外层8电子稳定结构 |
下列说法中,正确的是
| A.离子化合物中,阴、阳离子间存在静电吸引力 |
| B.HF、HCl、HBr和HI的热稳定性和还原性从左到右依次减弱 |
| C.第三周期非金属元素对应的含氧酸从左到右依次增强 |
| D.短周期元素形成离子后,最外层电子数都达到8电子稳定结构 |
X、Y、Z、W是原子序数依次递增的4种短周期元素。其中X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z原子的L层电子数比K层与M层电子数之和多5个,W在同周期元素中非金属性最强。下列说法正确的是( )
| A.X、Y、Z 3种元素组成的化合物中阴、阳离子所含电子数不等 |
| B.X与Z为同主族元素,它们的单质与W单质反应均失去电子 |
| C.Y、Z、W 3种元素组成的某种化合物可用于消毒 |
| D.Y与Z的单质在常温下反应生成Z2Y2 |
已知a、b分别为同周期的ⅡA族和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是( )
| A.m=" n" —15 | B.n=m+12 | C.m=n —29 | D.n=m+5 |
质量数为A,核内中子数为N的R2+离子与16O所形成的Wg氧化物中所含质子的物质的量为 ( )
A. mol mol | B.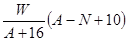 mol mol |
| C.(A-N+8)mol | D.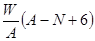 mol mol |
下列叙述中,正确的是
| A.同周期元素中,ⅦA族元素的原子半径最大 |
| B.ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C.室温时,0族元素的单质都是气体 |
| D.元素周期表中,从ⅢB到ⅡB这10个纵行的元素都是副族元素 |