题目内容
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应生成氮气和水蒸气。已知:
①N2(g)+2O2(g)===N2O4(g)ΔH=+8.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0 kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式正确的是
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-542.7 kJ·mol-1
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 076.7 kJ·mol-1
C.N2H4(g)+![]() N2O4(g)===
N2O4(g)===![]() N2(g)+2H2O(g) ΔH=-1 076.7 kJ·mol-1
N2(g)+2H2O(g) ΔH=-1 076.7 kJ·mol-1
D.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 059.3 kJ·mol-1
【答案】B
【解析】
肼(N2H4)是火箭发动机的燃料,它与N2O4反应生成氮气和水蒸气,已知:①N2(g)+2O2(g)=N2O4(g) ΔH=+8.7kJ·mol-1,②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1,将方程式②×2-①得N2H4跟N2O4反应的热化学方程式,2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7kJ·mol-1或N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g) ΔH=-538.35kJ·mol-1,B选项符合题意;
N2(g)+2H2O(g) ΔH=-538.35kJ·mol-1,B选项符合题意;
答案选B。

 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁,实验室制备装置和工业制备流程图如下:
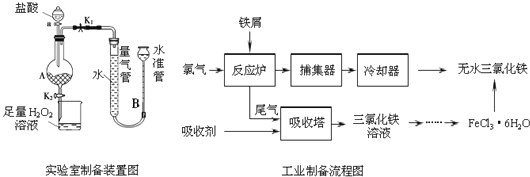
已知:(1)无水FeCl3的熔点为555K、沸点为588K.
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl36H2O晶体.
请回答:
(1)烧杯中足量的H2O2溶液的作用是______________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________________。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入______________后、_________________、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:_____________________。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmolL-1Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定终点的现象是:_____________________。
②样品中氯化铁的质量分数________________。