题目内容
某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI.(1)用这五种物质组成一个合理的未配平的离子方程式:
(2)若水是产物,请配平该反应的方程式,并标出电子转移方向与数目:
(3)pH为5-9时,体系中的氧化反应为HI→I2;当时pH<4,反应方向改变,此时体系中的氧化反应为
(4)该反应表明溶液的酸碱性影响物质的
(5)某学生往一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH 溶液 D.稀H2SO4 E.氯水
发现溶液颜色按如下顺序变化:①无色→②棕黄→③蓝→④无色→⑤蓝.请依据溶液颜色的变化,回答下列问题:
(i)加入以上药品的顺序是(写序号)
(ii)③→④反应的化学方程式为
分析:(1)根据对五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI,具有相同中心元素化合价变化分析进行解答;
(2)元素处于最高价时只有氧化性,处于最低价时只有还原性,若水是产物,发生Na3AsO4+HI→Na4AsO3+H2O+I2;
(3)当pH<4时,反应向逆反应方向进行,即反应从I2→HI,碘元素发生了还原反应,As发生了氧化反应;
(4)根据(3)可知:pH为5-9时,体系中的氧化反应为HI→I2;当时pH<4,体系中的氧化反应为Na3AsO3→Na3AsO4,据此分析解答;
(5)KI为无色溶液,加入氯水反应生成碘,变为棕黄色,然后加淀粉变蓝,再加NaOH反应生成NaI、NaIO,溶液又变为无色,最后加硫酸,发生氧化还原反应生成单质碘,溶液中还有淀粉,则变蓝,以此来解答.
(2)元素处于最高价时只有氧化性,处于最低价时只有还原性,若水是产物,发生Na3AsO4+HI→Na4AsO3+H2O+I2;
(3)当pH<4时,反应向逆反应方向进行,即反应从I2→HI,碘元素发生了还原反应,As发生了氧化反应;
(4)根据(3)可知:pH为5-9时,体系中的氧化反应为HI→I2;当时pH<4,体系中的氧化反应为Na3AsO3→Na3AsO4,据此分析解答;
(5)KI为无色溶液,加入氯水反应生成碘,变为棕黄色,然后加淀粉变蓝,再加NaOH反应生成NaI、NaIO,溶液又变为无色,最后加硫酸,发生氧化还原反应生成单质碘,溶液中还有淀粉,则变蓝,以此来解答.
解答:解:(1)首先在这几种物质中有两对物质化合价变化:I2(碘为0价)→HI(I为-1价),Na3AsO3(As为+3价)→Na3AsO4(As为+5价),所以可能发生:Na3AsO4+HI→Na4AsO3+H2O+I2(未配平)或Na3AsO3+H2O+I2→Na3AsO4+HI(未配平),
故答案为:Na3AsO4+HI→Na4AsO3+H2O+I2(未配平)或Na3AsO3+H2O+I2→Na3AsO4+HI(未配平);
(2)当元素处于最高价时只有氧化性,所以Na3AsO4在反应中做氧化剂,对应的产物为Na3AsO3,当元素处于最低价时只有还原性,所以HI在反应中做还原剂,对应的产物为I2,2HI→I2,转移2e-,该反应的方程式为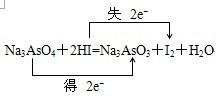 ,
,
故答案为: ;
;
(3)当pH<4时,反应从I2→HI,碘元素发生了还原反应,转移电子数目为2e-,则另一个半反应应该是发生了氧化反应,即为Na3AsO3(As为+3价)→Na3AsO4(As为+5价),转移电子数目为2e-,
故答案为:Na3AsO3→Na3AsO4;
(4)pH为5-9时,体系中的氧化反应为HI(I为-1价)→I2(碘为0价),体系的还原反应为Na3AsO4(As为+5价)→Na3AsO3(As为+3价),反应为:Na3AsO4+HI→Na4AsO3+H2O+I2(未配平),
当pH<4时,反应方向改变,发生Na3AsO3+H2O+I2→Na3AsO4+HI(未配平),所以溶液的酸碱性影响物质的氧化性、还原性,
故答案为:氧化性、还原性;
(5)KI为无色溶液(选A),加入氯水(选E)反应生成碘,变为棕黄色,然后加淀粉变蓝(选B),再加NaOH(选C)反应生成NaI、NaIO,溶液又变为无色,最后加硫酸(选D),发生氧化还原反应生成单质碘,溶液中还有淀粉,则变蓝,所以加入以上药品的顺序是A→E→B→C→D,③→④反应的化学方程式为I2+2NaOH═NaI+NaIO+H2O,
故答案为:A→E→B→C→D;I2+2NaOH═NaI+NaIO+H2O.
故答案为:Na3AsO4+HI→Na4AsO3+H2O+I2(未配平)或Na3AsO3+H2O+I2→Na3AsO4+HI(未配平);
(2)当元素处于最高价时只有氧化性,所以Na3AsO4在反应中做氧化剂,对应的产物为Na3AsO3,当元素处于最低价时只有还原性,所以HI在反应中做还原剂,对应的产物为I2,2HI→I2,转移2e-,该反应的方程式为
 ,
,故答案为:
 ;
;(3)当pH<4时,反应从I2→HI,碘元素发生了还原反应,转移电子数目为2e-,则另一个半反应应该是发生了氧化反应,即为Na3AsO3(As为+3价)→Na3AsO4(As为+5价),转移电子数目为2e-,
故答案为:Na3AsO3→Na3AsO4;
(4)pH为5-9时,体系中的氧化反应为HI(I为-1价)→I2(碘为0价),体系的还原反应为Na3AsO4(As为+5价)→Na3AsO3(As为+3价),反应为:Na3AsO4+HI→Na4AsO3+H2O+I2(未配平),
当pH<4时,反应方向改变,发生Na3AsO3+H2O+I2→Na3AsO4+HI(未配平),所以溶液的酸碱性影响物质的氧化性、还原性,
故答案为:氧化性、还原性;
(5)KI为无色溶液(选A),加入氯水(选E)反应生成碘,变为棕黄色,然后加淀粉变蓝(选B),再加NaOH(选C)反应生成NaI、NaIO,溶液又变为无色,最后加硫酸(选D),发生氧化还原反应生成单质碘,溶液中还有淀粉,则变蓝,所以加入以上药品的顺序是A→E→B→C→D,③→④反应的化学方程式为I2+2NaOH═NaI+NaIO+H2O,
故答案为:A→E→B→C→D;I2+2NaOH═NaI+NaIO+H2O.
点评:本题是一道有关氧化还原知识的题目,考查了方程式中的电子转移知识,综合性较强,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
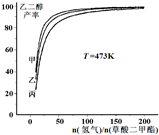 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
 HOCH2-CH2OH(g)+2CH3OH(g)
△H = -34 kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g)
△H = -34 kJ/mol
 H++OH-、HC2O4-
H++OH-、HC2O4- CH3OH(g)+H2O(g) △H
= —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H
= —49.0kJ/mo1.
 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液 mL混合反应而得,则下列说法中正确的是 __。
mL混合反应而得,则下列说法中正确的是 __。