题目内容
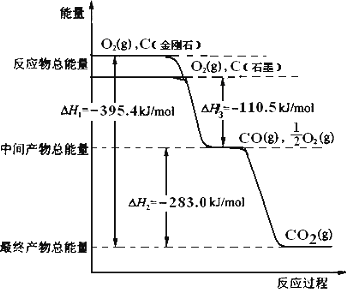
发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)该过程中产生的的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K =____________。
(2)CH3OH(l)气化时吸收的热量为27 kJ/mol,CH3OH(g)的燃烧热为677 kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式_________________。
(3) “催化还原”反应制乙二醇原理如下:
CH3OOC-COOCH3(g)+4H2(g)
 HOCH2-CH2OH(g)+2CH3OH(g)
△H = -34 kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g)
△H = -34 kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究。下图表示乙二醇达到平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5 MPa、2.5 MPa、3.5 MPa的情况,则曲线甲对应的压强是P(甲)=___________。

(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
① 草酸氢钾溶液中存在如下平衡:
H2O H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和
。
H++C2O42-和
。
② 向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是 (填序号)。
a.c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)
b.c(K+) + c(Na+) = c(HC2O4-) + c(C2O42-)
c.c(Na+) = c(H2C2O4) + c(C2O42-)
d.c(K+) > c(Na+)
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为 ;若以甲烷代替该燃料电池中的甲醇,向外界提供相等电量,则每代替32 g甲醇,所需标准状况下的甲烷的体积为 L。
(14分)
(1)K=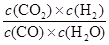
(2)CH3OH(l) +3/2O2(g) = CO2(g)+2H2O(l) ∆H = -650 kJ /mol
(3)3.5 MPa
(4)①
HC2O4-+H2O H2C2O4+OH- ② a d
H2C2O4+OH- ② a d
(5)CH3OH+H2O-6e-=CO2+6H+ 16.8
【解析】
试题分析:
(2)① CH3OH(l)= CH3OH(g) ∆H = 27 kJ /mol
② CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(g) ∆H = -677 kJ /mol
①+② 得 CH3OH(l) +3/2O2(g) = CO2(g)+2H2O(l) ∆H = -650 kJ /mol
(3)压强越大,速率越大,达平衡所需的时间越短,甲的时间最短,对应的压强最大,为3.5 MPa
(4)①HC2O4- 既有电离又有水解。②a为物料守恒,正确;b为电荷守恒,错误,正确的为c(H+)+c(K+) + c(Na+) = c(HC2O4-) + 2c(C2O42-)+c(OH-);c错误;向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,草酸氢钾溶液呈酸性,若草酸氢钾和NaOH溶液恰好反应,生成K2C2O4和Na2C2O4,它们水解呈碱性,要呈中性,应是草酸氢钾>NaOH,即c(K+) > c(Na+),d正确,选a d 。
(5)总: CH3OH+3/2O2= CO2+2H2O 酸性电解质的正极反应式:3/2O2+6 H++6e-=3 H2O
负极反应式=总-正极反应式 得:CH3OH+H2O-6e-=CO2+6H+
CH4 +2H2O -8e-= CO2+8 H+ ,32 g甲醇相当于1mol ,有6 mol电子转移,提供相等电量,需3/4 mol CH4,V=nVm=3/4*22.4= 16.8(L)
考点:本题考查平衡常数,盖斯定律,平衡移动,溶液里的离子平衡,溶液里的离子浓度比较,原电池的电极反应等知识。