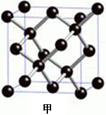
题目内容
(11分)(1)下列物质在固态时,属于分子晶体的有 ,属于原子晶体的 ,属于离子晶体的有 。①金刚石 ②氩 ③水晶 ④水银 ⑤氧化铝 ⑥P4 ⑦苯
(2)比较下列物质的有关性质(用“>.<.=或≈”号连接)
沸点:16O2 18O2 熔点:Na K 稳定性:H2O D2O
(3)某常见固体能导电,质软,它可能属于
(4)在氯化钠晶体(见图1)中,每个钠离子与 个最近且等距离的氯离子以 键相结合,与每个氯离子最近的且等距离的氯离子有 个。由于晶体中离子按一定的规律排列,必然造就了一颗完美晶体特定的几何外形,其中,氯化钠单晶的宏观外形为 。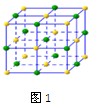
(2)比较下列物质的有关性质(用“>.<.=或≈”号连接)
沸点:16O2 18O2 熔点:Na K 稳定性:H2O D2O
(3)某常见固体能导电,质软,它可能属于
| A.分子晶体 | B.原子晶体 | C.离子晶体 | D.金属晶体 E.混合晶体 |

(每空1分,11分)(1)②⑥⑦ ①③ ⑤
(2)<(若答“≈”也给分,但答“=”不给分) > ≈或=
(3)DE
(4)6 离子 12 正方体
(2)<(若答“≈”也给分,但答“=”不给分) > ≈或=
(3)DE
(4)6 离子 12 正方体
(1)分子间通过分子间作用力形成的晶体是分子晶体,则答案选②⑥⑦;原子间通过共价键形成的空间网状结构的晶体是原子晶体,因此答案选①③;离子间通过离子键形成的晶体是离子晶体,所以答案选⑤。
(2)氧气形成的晶体是分子晶体,沸点大小和分子间作用力有关系。相对分子质量越大,分子间作用力越强,沸点越高。所以沸点是16O2 小于18O2。钠和钾形成晶体都是金属晶体,形成金属晶体的金属阳离子半径越小,电荷数越多,金属键越强,熔点越高。钠离子半径小于钾离子半径,所以金属钠的熔点大于钾的。同位素原子的化学性质几乎都是相同的,所以H2O和D2O稳定性相同。
(3)某常见固体能导电,质软,则一定不是离子晶体和分子晶体,所以它可能属于金属晶体或者是石墨,石墨是混合型晶体,因此答案选DE。
(4)氯化钠晶体的配位数是6,形成的晶体是离子晶体。根据晶胞的结构可知,氯化钠单晶的宏观外形是正方体,与每个氯离子最近的且等距离的氯离子有12个。
(2)氧气形成的晶体是分子晶体,沸点大小和分子间作用力有关系。相对分子质量越大,分子间作用力越强,沸点越高。所以沸点是16O2 小于18O2。钠和钾形成晶体都是金属晶体,形成金属晶体的金属阳离子半径越小,电荷数越多,金属键越强,熔点越高。钠离子半径小于钾离子半径,所以金属钠的熔点大于钾的。同位素原子的化学性质几乎都是相同的,所以H2O和D2O稳定性相同。
(3)某常见固体能导电,质软,则一定不是离子晶体和分子晶体,所以它可能属于金属晶体或者是石墨,石墨是混合型晶体,因此答案选DE。
(4)氯化钠晶体的配位数是6,形成的晶体是离子晶体。根据晶胞的结构可知,氯化钠单晶的宏观外形是正方体,与每个氯离子最近的且等距离的氯离子有12个。

练习册系列答案
相关题目
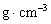 。(用带A计算式表示)
。(用带A计算式表示) ,该物质的一个分子中含有300~500个碳原子,性质很活泼。下列关于该链式炔碳的熔点判断正确的是( )
,该物质的一个分子中含有300~500个碳原子,性质很活泼。下列关于该链式炔碳的熔点判断正确的是( )