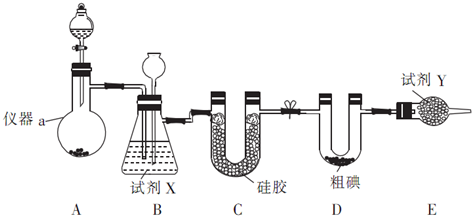
题目内容
9.催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺.
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高活性.图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:微波水热法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是Co2+.
(2)H2S热分解制氢时(2H2S(g)=2H2(g)+S2(g)△H=+169.8kJ•mol-1),常向反应容器中通入一定比例的空气,使部分H2S燃烧,其目的是为H2S热分解反应提供热量.
(3)在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,则N2H4发生分解反应的化学方程式为3N2H4$?_{△}^{催化剂}$N2+4NH3;为抑制肼的分解,可采取的合理措施有降低反应温度、增加压强等(写两种).
分析 (1)过氧化氢的分解速率越大,催化剂活性更高;随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大;
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量;
(3)使湿润的红色石蕊试纸变蓝的气体为氨气,由图1得知:温度越高,肼的百分含量越低,即分解的越快,升压平衡逆向移动,所以增加压强也抑制肼的分解.
解答 解:(1)过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,故Co2+的催化活性更高,故答案为:微波水热;Co2+;
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,放出热量,为H2S热分解反应提供热量;故答案为:为H2S热分解反应提供热量;
(3)使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N2H4$?_{△}^{催化剂}$N2+4NH3,由图1可知,温度越高,肼的体积分数含量越低,故要抑制肼的分解,应降低反应温度,升压平衡逆向移动,所以增加压强也抑制肼的分解,
故答案为:3N2H4$?_{△}^{催化剂}$N2+4NH3;降低反应温度、增加压强等.
点评 本题考查学生对实验原理理解、方案设计的评价等,难度中等,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
19.检验SO2中是否含有CO2应采用的方法是( )
| A. | 通过澄清石灰水 | |
| B. | 先通过NaHCO3溶液,再通过澄清石灰水 | |
| C. | 通过品红溶液 | |
| D. | 先通过足量的酸性高锰酸钾溶液,再通过澄清石灰水 |
20.今有如下三个热化学方程式:
H2(g)+$\frac{1}{2}$ O2 (g)═H2O (g)△H=a kJ•mol-1
H2 (g)+$\frac{1}{2}$ O2 (g)═H2O (l)△H=b kJ•mol-1
2H2 (g)+O2 (g)═2H2O (g)△H=c kJ•mol-1
关于它们的下列表述正确的是( )
H2(g)+$\frac{1}{2}$ O2 (g)═H2O (g)△H=a kJ•mol-1
H2 (g)+$\frac{1}{2}$ O2 (g)═H2O (l)△H=b kJ•mol-1
2H2 (g)+O2 (g)═2H2O (g)△H=c kJ•mol-1
关于它们的下列表述正确的是( )
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 | ||
| C. | a=b | D. | 2a=c |
17.下列事实不能用勒夏特列原理解释的是( )
| A. | 打开啤酒瓶盖,逸出大量气泡 | |
| B. | 实验室可以用排饱和食盐水的方法收集氯气 | |
| C. | 将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉时的快 | |
| D. | 在pH等于3的醋酸溶液中加入少量CH3COONH4固体,溶液pH增大 |
4.一定条件下存在反应:2SO2(g)+O2(g)═2SO3(g),△H<0.现有三个体积相同的密闭容器 I、II、III,按如如图所示投料,并在400℃条件下开始反应.达到平衡时,下列说法正确的是( )


| A. | SO2的体积分数:II>III | |
| B. | 容器I、III中反应焓变不同 | |
| C. | 容器II、III中正反应速率相同 | |
| D. | 容器 I中SO2的转化率与容器 II中SO3的转化率之和小于1 |
1.将pH=4的酸性溶液与pH=10的NaOH溶液等体积混合后,溶液的pH可能是( )
| A. | 等于7 | B. | 大于7 | C. | 小于7 | D. | 无法确定 |
19.碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用.
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是SiO2+2NaOH═Na2SiO3+H2O(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是D.
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
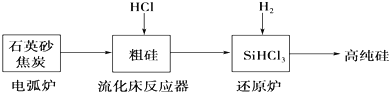
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
③SiHCl3极易水解,其完全水解的化学方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是SiO2+2NaOH═Na2SiO3+H2O(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是D.
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |