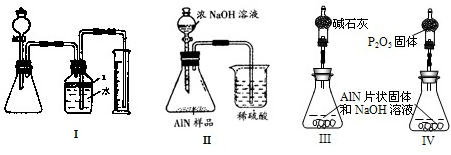
题目内容
超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+(1)称取10.00 g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36 L(标准状况)。
①上述反应的化学方程式为_______________________________________________________。
②该样品中的AlN的质量分数为_____________。
(2)另取10.00 g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.14 g·L-1(已折算成标准状况,AlN不跟O2反应)。该样品中含杂质炭___________ g。
思路解析:(1)设与碱反应的氮化铝为x摩,
AlN+NaOH+H2O![]() NaAlO2+NH3↑
NaAlO2+NH3↑
1 mol 1 mol
x mol 0.15 mol
解得:x=0.15mol,
则氮化铝在样品中的质量分数=![]() =61.5%
=61.5%
(2)设样品中炭的物质的量为2y mol
![]() 2CO
2CO
始: 0.09 mol 0
转:-2ymol -y mol +y mol
平: 0 (0.09-y) mol y mol
根据已知条件有:![]() =1.14×22.4,解得y=0.08 mol,即炭的物质的量为0.16 mol,质量为1.92 g。
=1.14×22.4,解得y=0.08 mol,即炭的物质的量为0.16 mol,质量为1.92 g。
答案:(1)①AlN+NaOH+H2O![]() NaAlO2+NH3 ②61.5% (2)1.92
NaAlO2+NH3 ②61.5% (2)1.92

练习册系列答案
相关题目