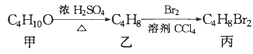题目内容
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:

已知:ZnS与稀硫酸反应,且化合价不变;CuS既不溶解于稀硫酸,也不与稀硫酸反应
(1)在下列装置中,第一次浸出反应装置最合理的___(填标号)。
A. B.
B.
C. D.
D.
(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下:____。(提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作____。
(4)写出第二次浸出的化学反应方程式___,向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加____。
(5)滤渣2的主要成分是___。浓缩、结晶得到硫酸锌晶体的主要仪器名称是____。
(6)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为____。
【答案】D 取少量滤液1,滴加高锰酸钾溶液,若褪色,则证明有亚铁离子 关小水龙头,使洗涤剂X
缓缓通过沉淀物 CuS+ H2O2+ H2SO4= CuSO4 +S+ 2H2O H2SO4 SiO2 蒸发皿 30.0%
【解析】
(1)根据题目化学工艺流程知,第一次浸出发生反应:ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑,有有毒的气体生成,必须用氢氧化钠溶液进行尾气处理,选D装置,故答案为D;
(2)亚铁离子具有还原性,可与高锰酸钾发生氧化还原反应,检验亚铁离子,可取少量滤液1,滴加高锰酸钾溶液,若褪色,则证明有亚铁离子,故答案为取少量滤液1,滴加高锰酸钾溶液,若褪色,则证明有亚铁离子;
(3)抽滤时,可关小水龙头,使洗涤剂X
缓缓通过沉淀物,故答案为关小水龙头,使洗涤剂X
缓缓通过沉淀物;
(4)第二次浸出时发生反应:CuS++H2O2+H2SO4=CuSO4+S+2H2O,不产生有毒气体,可以选用A装置,第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液.若顺序相反,会造成H2O2与固体颗粒接触分解,故答案为CuS+H2O2+H2SO4=CuSO4+S+2H2O;H2SO4;
(5)二氧化硅不与硫酸反应,滤渣2的主要成分是SiO2,含有少量S,浓缩、结晶得到硫酸锌晶体的主要仪器是蒸发皿,故答案为SiO2、S;蒸发皿;
(6)废催化剂中Cu的物质的量为15.0g×12.8%÷96g/mol=0.02mol,1.5g CuSO4﹒5H2O中Cu的物质含量的为1.5g÷250g/mol=0.006mol,则铜的回收率为![]() ×100%=30%,故答案为30%。
×100%=30%,故答案为30%。

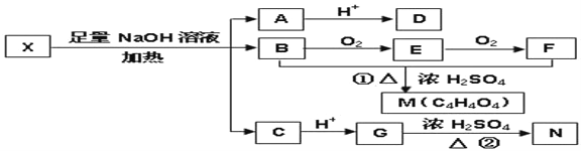
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图:
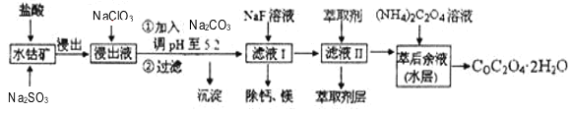
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是_____。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为_____。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_____。
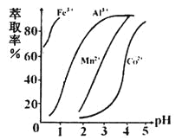
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,在滤液II中适宜萃取的pH为_____左右。
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液![]() =____。
=____。
(6)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K=1.8×10-5,H2SO3的电离平衡常数K1=1.2×10-2,K2=1.3×10-8。在通废气的过程中,当恰好形成正盐时,溶液中离子浓度的大小关系为____。
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) ΔH=+183 kJ/mol
2NO(g) ΔH=+183 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-1164.4 kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) ΔH=______kJ/mol
2NH3(g) ΔH=______kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_______。
②按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

ⅰ X代表的物理量是______。
ⅱ 判断L1、L2的大小关系,并简述理由______。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
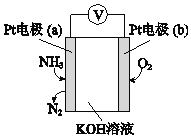
①电极b上发生的是______反应(填“氧化”或“还原”)。
②写出电极a的电极反应式_________。