题目内容
【题目】(1)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:
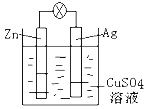
①Zn电极是_______(填“正极”或“负极”),反应中质量会变______(填“大”,“小”或“不变”)
②银电极上发生_____反应(“氧化”或“还原”),电极反应式为__________。
(2)甲醇(CH3OH)是一种重要的化工原料,在生产中有着重要的应用。甲醇燃料电池能量转化率高,对环境无污染。该燃料电池的工作原理如图所示:(质子交换膜可以通过H+)
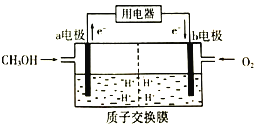
通入甲醇气体的电极为电池的_____(填“正”或“负")极,电解质溶液中H+向_____电极移动(填“a"或“b")。
【答案】负极 小 还原反应 Cu2++2e-=Cu 负 b
【解析】
(1)由图可知,Zn为负极,负极上电极反应式为Zn-2e-=Zn2+,失去电子被氧化生成锌离子,质量减小;Ag为正极,正极上Cu2+得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故答案为:负极,小,还原反应,Cu2++2e-=Cu。
(2)由图示可知:该燃料电池中,通入甲醇的电极是负极、通入氧气的电极是正极,所以a为负极,b为正极,原电池中阳离子向正极移动、阴离子向负极移动,所以H+向b电极移动,故答案为:负;b。

练习册系列答案
相关题目