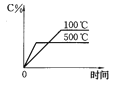
题目内容
【题目】下列有关 HCl 和 HBr 的叙述错误的是( )
A.键能:HCl>HBrB.热稳定性:HBr>HCl
C.沸点:HBr>HClD.共用电子对偏移程度:HCl>HBr
【答案】B
【解析】
A.Cl的非金属性比Br强,所以键能HCl>HBr,A正确;
B.非金属性Br<Cl,所以热稳定性:HBr<HCl,B错误;
C.相对分子质量HBr>HCl,分子间作用力HBr>HCl,所以沸点HBr>HCl,C正确;
D.Cl的非金属性比Br强,吸引共用电子对的能力比溴强,所以共用电子对偏移程度:HCl>HBr,D正确;
故选B。

【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可与钠反应放出气体。A中存在的化学键类型是______;
A.离子键 B.共价键 C.金属键 D.氢键
B分子中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,写出该配离子的化学式______________。
(6)e单质为面心立方晶体,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率为________。
【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
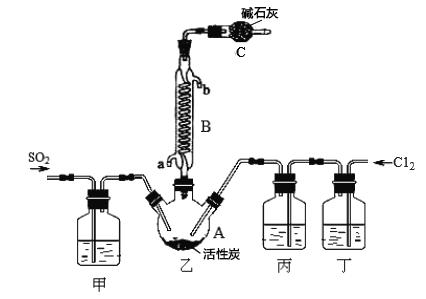
(1)从下表中选择相应的装置完成填空:
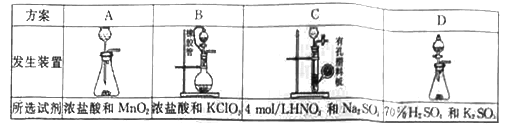
①制备SO2选________(填字母)。
②写出用所选装置制取Cl2的离子方程式_________________。
(2)合成SO2C12的装置图中仪器B的名称为_________________;丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)为提高本实验中的产率,在实验操作中还需要注意的事项有(只答—条即可)__________。
(6)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。