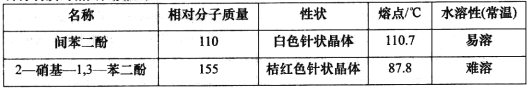
题目内容
【题目】镀镍废水中含有氰根(CN-),其质量浓度往往高于国家排放标准规定的范围,需要进行破氰处理。用化学法处理电镀废水中的氰化物,一般采用碱性氰化法和双氧水氧化法。
I、碱性氯化法是在废水中加入NaOH使Ni2+生成Ni(OH)2沉淀,同时加NaClO将CN-氧化为无毒物质,但此法中ClO-在碱性条件下会和Ni2+反应生Ni(OH)3沉淀和Cl-而大量消耗,反应的离子反应方程式为_______________________________________;
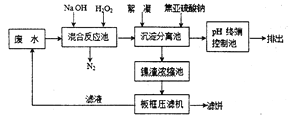
Ⅱ、双氧水氧化法的简易工艺流程如下:

(1)混合反应池中,在碱性条件下H2O2氧化CN-却不会和Ni2+反应,此反应的离子方程式为______________;H2O2还会以质量比为25:2的比例氧化废水中的有机添加剂,降低废水的COD值。
(2)沉淀分离池中,加入焦亚硫酸钠(Na2S2O5)还原除去过量的H2O2,否则会影响沉淀的絮凝沉降,请分析原因________________________________;
(3)向废水中加入30%H2O2(密度为1.11g/mL)的用量为1mL/L,处理前后CN-和有机添加剂的质量浓度如下表所示,若不考虑H2O2的自身分解和溶液体积的变化。请计算需在沉淀分离池中至少加入焦亚硫 酸钠(Na2S2O5)的量为_________g/L(计算结果保留到小数点后两位)。写出计算过程。

【答案】
I、ClO-+2Ni2++4OH-+H2O=2Ni(OH)3↓+Cl-
Ⅱ、(1)5H2O2+2CN-+2OH-=N2↑+2CO32-+6H2O 或5H2O2 +2CN-=N2↑+2HCO3-+4H2O,(2)H2O2分解产生O2,会吸附在沉淀颗粒上,使沉淀上浮不利于沉降。 (3)0.80g/L
【解析】
试题分析:I、ClO-在碱性条件下和Ni2+反应生Ni(OH)3沉淀和Cl-,反应的离子反应方程式为ClO-+2Ni2++4OH-+H2O=2Ni(OH)3↓+Cl-;
Ⅱ、双氧水氧化法的简易工艺流程如下:
(1)在碱性条件下H2O2氧化CN-生成N2,发生反应的离子方程式为5H2O2+2CN-+2OH-=N2↑+2CO32-+6H2O或5H2O2 +2CN-=N2↑+2HCO32-+4H2O;
(2)过量的H2O2分解产生O2,会吸附在沉淀颗粒上,使沉淀上浮不利于沉降,故需要用焦亚硫酸钠(Na2S2O5)还原除去过量的H2O2;
(3)设废水为1L,则加入的H2O2溶液为1mL,反应掉的CN-的质量为5.41mg-0.21mg=5.2mg,物质的量为![]() =0.2×10-3mol,消耗H2O2的物质的量为0.2×10-3mol×
=0.2×10-3mol,消耗H2O2的物质的量为0.2×10-3mol×![]() =0.5×10-3mol,有机添加剂反应掉的质量为2.37mg-0.02mg=2.35mg,消耗的H2O2的质量为2.35mg×
=0.5×10-3mol,有机添加剂反应掉的质量为2.37mg-0.02mg=2.35mg,消耗的H2O2的质量为2.35mg×![]() =29.375mg, (Na2S2O5)还原除去的H2O2的物质的量为
=29.375mg, (Na2S2O5)还原除去的H2O2的物质的量为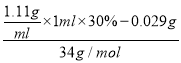 -0.5×10-3mol,根据电子规律,需要焦亚硫酸钠的质量为(
-0.5×10-3mol,根据电子规律,需要焦亚硫酸钠的质量为(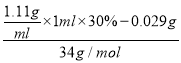 -0.5×10-3mol)×
-0.5×10-3mol)×![]() ×190g/mol=0.80g,则需在沉淀分离池中至少加入焦亚硫酸钠(Na2S2O5)的量为0.80g/L。
×190g/mol=0.80g,则需在沉淀分离池中至少加入焦亚硫酸钠(Na2S2O5)的量为0.80g/L。