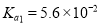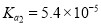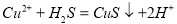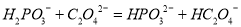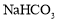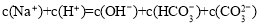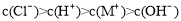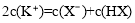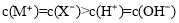题目内容
(4分)将3.84 g Fe和Fe2O3的混合物溶于120 mL的盐酸,刚好完全反应,生成0.03 mol H2,若反应后的溶液中无Fe3+,且溶液体积不变,试求:
(1)原混合物中Fe2O3的质量为 ;
(2)原盐酸的物质的量浓度为 。
(1)原混合物中Fe2O3的质量分别为1.6g
(2)盐酸的物质的量浓度为1mol/L
【解析】
试题分析:(1)设原混合物中Fe和Fe2O3的物质的量分别为x、y,由刚好完全反应,生成0.03molH2,反应后的溶液中无Fe3+,则 Fe2O3+6H+=2Fe3++3H2O,还原Fe3+需Fe
y 2y
Fe+2Fe3+=3Fe2+
y 2y
Fe+2H+=Fe2++H2↑
(x-y) 0.03mol
可得x?y=0.03mol,56x+160y=3.84,解得x=0.04mol,y=0.01mol,则 m(Fe2O3)=0.01 mol×160 g?mol-1=1.6g。
(2)n(HCl)=2n(FeCl2)=2[n(Fe)+2n(Fe2O3)]=2×0.06 mol=0.12 mol,
c(HCl)=0.12 mol÷0.12L=1mol?L?1。
考点:本题考查根据化学方程式的计算。

 名校课堂系列答案
名校课堂系列答案类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
| 已知 | 类推 |
A. | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
B. | 向稀硫酸中加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液中加入Ba(OH)2溶液至中性 H++OH-=H2O |
C. | 向氯化铝溶液中加入足量NaOH溶液 Al3+ + 4OH- = AlO2- + 2H2O | 向氯化铝溶液中加入足量氨水 Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+ |
D. | 向Ca(OH)2溶液中通入过量CO2 CO2 + OH- = HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2 + OH- = HSO3- |