��Ŀ����
�ȣ�Sr��Ϊ�������ڢ�A��Ԫ�أ��仯������ˮ�Ȼ��ȣ�SrCl2��6H2O����ʵ������Ҫ�ķ����Լ�����ҵ�ϳ�������ʯ����Ҫ�ɷ�ΪSrSO4��Ϊԭ���Ʊ��������������£�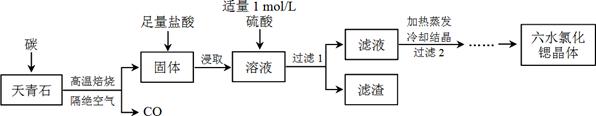
��֪���� �������ȡ����Һ�г�����Sr2+��Cl���⣬����������Ba2+���ʣ�
�� SrSO4��BaSO4���ܶȻ������ֱ�Ϊ3.3��10��7��1.1��10��10��
�� SrCl2��6H2O��Ħ������Ϊ��267 g/mol��
��1������ʯ����ǰ����ĥ���飬��Ŀ����_________________________________________��
��2�������������±��գ���0.5 mol SrSO4��ֻ��S����ԭ��ת����4 mol���ӡ�д���÷�Ӧ�Ļ�ѧ����ʽ��_____________________________________________��
��3��Ϊ�˵õ��ϴ�����ˮ�Ȼ��Ⱦ��壬����2������е�����������_______________��
��4�����������Ŀ����______________________��Ϊ�����ԭ�ϵ������ʣ���Һ��Sr2+��Ũ��Ӧ������_________ mol/L��ע����ʱ��Һ��Ba2+Ũ��Ϊ1��10��5 mol/L����
��5����Ʒ���ȼ�⣺��ȡ1.000 g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO3 1.100��10��2 mol��AgNO3��Һ����Һ�г�Cl�D�⣬����������Ag+��Ӧ�����ӣ�����Cl�D��ȫ�������ú�Fe3+����Һ��ָʾ������0.2000 mol/L��NH4SCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag+ ��AgSCN��ɫ��������ʽ������
�ٵζ���Ӧ�ﵽ�յ��������_________________________________________��
�����ζ�������ȥ����Ũ�ȵ�NH4SCN��Һ20.00 mL�����Ʒ��SrCl2��6H2O�������ٷֺ���Ϊ______________������4λ��Ч���֣���
��1������ʯ����ǰ����ĥ���飬��Ŀ����Ϊ�����ӷ�Ӧ��ĽӴ���������ѧ��Ӧ���ʡ�
��2��SrSO4 + 4C  SrS + 4CO��
SrS + 4CO��
��3��ϴ�ӡ�������ɣ�
��4����ȥ��Һ��Ba2+���� 0.03
��5����Һ����ɫ��ΪѪ��ɫ����30 s����ɫ 93.45%
���������������1������ʯ����ǰ����ĥ���飬��Ŀ����Ϊ�����ӷ�Ӧ��ĽӴ���������ѧ��Ӧ���ʣ��Ӷ����ԭ�ϵ�ת���ʡ���2���ڱ��յĹ�������ֻ��0.5 mol SrSO4��ֻ��S����ԭ��ת����4 mol���ӣ���1mol��Sת��8mol�ĵ��ӣ������ڷ�ӦǰԪ�صĻ��ϼ�Ϊ+6�ۣ����Է�Ӧ��Ԫ�صĻ��ϼ�Ϊ-2�ۡ����̼������ʯ�ڸ����·�����ӦSrSO4 + 4C SrS + 4CO������3��Ȼ����õ��ĺ���SrS�����м���HCl������Ӧ��SrS+2HCl= SrCl2+H2S��������Һ����Ũ������ȴ�ᾧ��Ȼ�����Һ�н�������˳�����ϴ�ӳ�ȥ������������Ӳ����и��TSrCl2��6H2O����4������HCl�ܽ�SrS�����Һ�м��������Ŀ���dz�ȥ��Һ��Ba2+���ʡ�������Ba2+Ũ��Ϊ1��10��5 mol/L��BaSO4���ܶȻ�����Ϊ1.1��10��10������c(SO42-)=1.1��10��10��1��10��5=1.1��10��5mol/L����SrSO4���ܶȻ�����Ϊ3.3��10��7������c(Sr2+)=3.3��10��7��1.1��10��5=3.0��10��2=0.03mol/L����5����NH4SCN����ʣ���Ag+ ����γ�AgSCN��ɫ��������Һ�оͻẬ��SCN�����ͻ���Fe3+�������������Һ��Ϊ��ɫ����˵ζ��ﵽ�յ�ʱ��Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��n(NH4SCN)="0.2000" mol/L��0.02L=4.0��10-3mol��������Һ��ʣ���Ag+�����ʵ���Ϊn(Ag+)=4.0��10-3mol,�����Cl�D��Ӧ��Ag+�����ʵ���Ϊn(Ag+)=1.100��10��2 mol��4.0��10-3mol=7.0��10-3mol n(SrCl2��6H2O)=3.5��10-3mol,m(SrCl2��6H2O)= 3.5��10-3mol��267 g/mol=0.9345g.���Բ�Ʒ����Ϊ0.9345g��1g��100%=93.45%.
SrS + 4CO������3��Ȼ����õ��ĺ���SrS�����м���HCl������Ӧ��SrS+2HCl= SrCl2+H2S��������Һ����Ũ������ȴ�ᾧ��Ȼ�����Һ�н�������˳�����ϴ�ӳ�ȥ������������Ӳ����и��TSrCl2��6H2O����4������HCl�ܽ�SrS�����Һ�м��������Ŀ���dz�ȥ��Һ��Ba2+���ʡ�������Ba2+Ũ��Ϊ1��10��5 mol/L��BaSO4���ܶȻ�����Ϊ1.1��10��10������c(SO42-)=1.1��10��10��1��10��5=1.1��10��5mol/L����SrSO4���ܶȻ�����Ϊ3.3��10��7������c(Sr2+)=3.3��10��7��1.1��10��5=3.0��10��2=0.03mol/L����5����NH4SCN����ʣ���Ag+ ����γ�AgSCN��ɫ��������Һ�оͻẬ��SCN�����ͻ���Fe3+�������������Һ��Ϊ��ɫ����˵ζ��ﵽ�յ�ʱ��Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��n(NH4SCN)="0.2000" mol/L��0.02L=4.0��10-3mol��������Һ��ʣ���Ag+�����ʵ���Ϊn(Ag+)=4.0��10-3mol,�����Cl�D��Ӧ��Ag+�����ʵ���Ϊn(Ag+)=1.100��10��2 mol��4.0��10-3mol=7.0��10-3mol n(SrCl2��6H2O)=3.5��10-3mol,m(SrCl2��6H2O)= 3.5��10-3mol��267 g/mol=0.9345g.���Բ�Ʒ����Ϊ0.9345g��1g��100%=93.45%.
���㣺�������ʵ��Ʊ��������ķ������ʴ��ȵļ����֪ʶ��

�����й���ϩ�ͱ�ȼ�յ�˵������ȷ����
| A����ȼǰ��Ҫ���鴿�� | B��������ͬʱ�����ĵ�������ͬ |
| C��ȼ��ʱ����������� | D�����ȼ�գ�������������̼��ˮ |
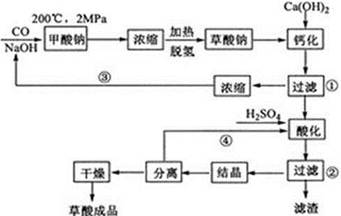
��16�֣��ߴ���ˮ�Ȼ��Ⱦ���(SrCl2��6H2O)���кܸߵľ��ü�ֵ����ҵ����������ˮ��̼���ȣ�SrCO3��Ϊԭ��(�������������Ļ������)���Ʊ��ߴ���ˮ�Ȼ��Ⱦ���Ĺ���Ϊ��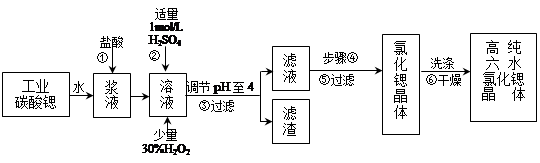
��֪�� ��. SrCl2��6H2O ������61��ʱ��ʼʧȥ�ᾧˮ��100��ʱʧȥȫ���ᾧˮ��
��.�й��������↑ʼ��������ȫ������pH����
| �������� | Fe(OH)3 | Fe(OH)2 |
| ��ʼ������pH | 1.5 | 6.5 |
| ������ȫ��pH | 3.7 | 9.7 |
��1�������ټӿ췴Ӧ���ʵĴ�ʩ�� (дһ��)��
̼���������ᷴӦ�����ӷ���ʽ ��
��2�����������£�����30% H2O2��Һ����Fe2+������Fe3+�������ӷ���ʽΪ ��
��3���ڲ����-�۵Ĺ����У�����Һ��pHֵ��1������4ʱ�����õ��Լ�Ϊ_______��
A����ˮ B���������ȷ�ĩ C�� �������� D��̼���ƾ���
��4����������������������Ҫ�ɷ��� (�ѧʽ)��
��5������ܵIJ����� �� ��
��6����ҵ�����ȷ紵����ˮ�Ȼ��ȣ����˵��¶���
A��50~60�� B��70~80�� C��80~100�� D��100������
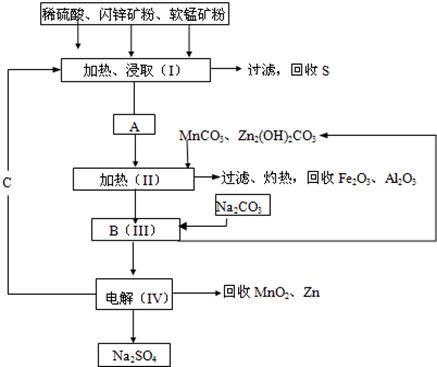
��14�֣����������Ҫ�ɷֿɱ�ʾΪFeO��Cr2O3��������MgO��Al2O3��Fe2O3�����ʣ��������Ը�����Ϊԭ���Ʊ��ظ���أ�K2Cr2O7��������ͼ��
��֪����4FeO?Cr2O3+8Na2CO3+7O2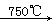 8Na2CrO4+2Fe2O3+8CO2����
8Na2CrO4+2Fe2O3+8CO2����
��Na2CO3+Al2O3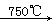 2NaAlO2+CO2����
2NaAlO2+CO2����
��Cr2CO72-+H2O 2CrO42-+2H+
2CrO42-+2H+
��������ش��������⣺
��1������X����Ҫ���� ����д��ѧʽ����Ҫ����ữ��������Һ��pH�Ƿ����4��5��Ӧ��ʹ�� ______________ ����д�������Լ����ƣ���
��2���ữ�����ô��������ҺpH��5����Ŀ���� _______________________ ��
��3���������жಽ��ɣ����K2Cr2O7����IJ��������ǣ�����KCl���塢����Ũ���� �����ˡ� �����
��4���±���������ʵ��ܽ�����ݣ�����III������Ӧ�Ļ�ѧ����ʽ�ǣ�Na2Cr2O7 + 2KCl��K2Cr2O7 ��+ 2NaCl���÷�Ӧ����Һ���ܷ�����������_____________________________��
| ���� | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| �ܽ�ȣ�g/100gˮ�� | 0�� | 28 | 35��7 | 4��7 | 163 |
| 40�� | 40��1 | 36��4 | 26��3 | 215 | |
| 80�� | 51��3 | 38 | 73 | 376 | |
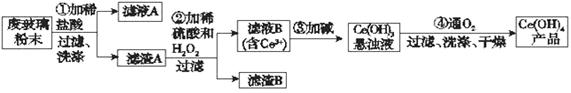
��5������ƷY��Ҫ��������������������þ���������ܻ����P���������ʣ���ȷ����Y���������������ķ����dz�ȡn g��Ʒ��������� ____ ����д�Լ������ܽ⡢���ˡ��� ����д�Լ������������ա���ȴ���������ø������m g��������Ʒ��������������������Ϊ ���ú�m��n�Ĵ���ʽ��ʾ����
���г�ȥ���ʵķ�������ȷ����
| A�����к��б������ʣ�������ˮ������ |
| B���Ҵ��к����������ʣ�����̼������Һ����Һ |
| C��FeCl3��Һ�к���CuCl2���ʣ�����������ۣ����� |
| D��CO2�к���HCl���ʣ�ͨ�뱥��NaHCO3��Һ��ϴ�� |
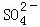 +2H2O
+2H2O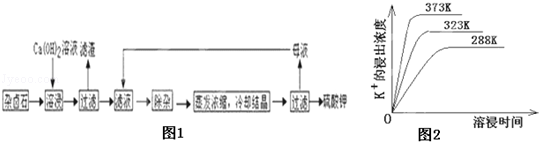
 ?CaCO3��s��+
?CaCO3��s��+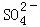
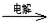 MnO2+Zn+2H2SO4��
MnO2+Zn+2H2SO4��